今日はちょっと長い論文になりますがシェアしたいと思います。
自動翻訳したものをコピペします。
難しくて読めない![]() という方は太字の部分だけ読んで下さい。
という方は太字の部分だけ読んで下さい。
ーーーーーーーーーーーーーーーーー
ワクチン接種の繰り返しによって誘導される IgG4 抗体は、SARS-CoV-2 スパイクタンパク質に対する免疫寛容を生み出す可能性がある
概要
コロナウイルス SARS-CoV-2 が世界的に出現してから 1 年も経たないうちに、mRNA 技術に基づく新しいワクチン プラットフォームが市場に導入されました。世界中で、さまざまなプラットフォームで約 133 億 8,000 万回分の新型コロナウイルス感染症ワクチンが投与されています。現在までに、総人口の72.3%が少なくとも1回は新型コロナウイルス感染症ワクチンを注射されています。
これらのワクチンによってもたらされる免疫は急速に弱まるため、最近、併存疾患を持つ人の入院や重篤な疾患を予防するワクチンの能力に疑問が持たれており、他の多くのワクチンと同様に、これらのワクチンは免疫を生成せず、人々が感染を防ぐことができることを示す証拠が増えています。頻繁に再感染を起こします。
さらに、最近の調査では、mRNA ワクチンを 2 回以上接種した人々の IgG4 レベルが異常に高いことが判明しました。HIV、マラリアおよび百日咳ワクチンも、通常よりも高い IgG4 合成を誘導することが報告されています。
全体として、IgG4 抗体へのクラススイッチを決定する重要な要因は 3 つあります。それは、過剰な抗原濃度、ワクチン接種の繰り返し、および使用するワクチンの種類です。
IgG4 レベルの増加は、IgE 誘発効果の阻害によるアレルゲン特異的免疫療法の成功時に起こる免疫の過剰活性化と同様に、免疫の過剰活性化を防ぐことで保護的な役割を果たす可能性があることが示唆されています。
しかし、新たな証拠は、mRNA ワクチンを繰り返しワクチン接種した後に検出される IgG4 レベルの増加が報告されているが、これは防御機構ではない可能性を示唆しています。
それよりも、これは、自然な抗ウイルス応答を抑制することによって、無抵抗の SARS-CoV2 感染と複製を促進する可能性があるスパイクタンパク質に対する免疫寛容機構を引き起こします。
高抗原濃度の mRNA ワクチン接種を繰り返すことによる IgG4 合成の増加も、自己免疫疾患を引き起こす可能性があり、感受性のある個人では癌の増殖や自己免疫性心筋炎を促進する可能性があります。
1. はじめに
新型コロナウイルス感染症(COVID-19)のパンデミックが始まってから比較的短期間で、2つのmRNAワクチン、BNT162b2(ファイザー・ビオンテック、米国ニューヨーク州ニューヨーク)とmRNA-1273(モデルナ、米国マサチューセッツ州ケンブリッジ)が最初のワクチン接種を受けた。 - これまでの緊急使用許可。
これらの mRNA ワクチンは、SARS-CoV-2 スパイクタンパク質を構築するために必要なコード配列を含む合成 mRNA 分子で構成される新しいタイプのワクチンであり、細胞への mRNA の送達を可能にする脂質ナノ粒子 (LNP) に包まれています。
mRNA ワクチン プラットフォームの主な特徴は、SARS-CoV-2 による自然感染を模倣してタンパク質が宿主細胞内で合成されることです。
最新の調査では、SARS-CoV-2 アルファ、デルタ、オミクロン変異型に感染した新型コロナウイルス感染症患者の症状の重症度、および米国の病院に入院した患者における各変異型に対する mRNA ワクチン接種の有効性が対比されている。
2021年3月から2022年1月まで。
新型コロナウイルス感染症(COVID-19)ワクチンは、アルファ、デルタ、オミクロンの変異種による集中治療室(ICU)への入院を回避するのに非常に有効(90%)であることが判明した。
ただし、Omicron 変異体に対する防御を得るには 3 回のワクチン注射が必要でしたが、Alpha および Delta 変異体に対しては 2 回のワクチン注射で十分に保護されました。
人々が病院に入院した場合、オミクロン変異種はデルタ変異体よりも臨床有害結果が少ないことが判明しました。それにもかかわらず、 Omicron 変異体は依然としてかなりの臨床症状と死亡率を引き起こしました。
これらのワクチンによる防御レベルについては矛盾する情報があることは注目に値します。米国疾病管理センター(CDC)は、パンデミック全体を通じて、ワクチン接種を受けていない人の死亡率がワクチン接種者よりも高かったと述べているが、英国のデータはCDCの調査結果と矛盾している。
具体的には、英国国家統計局(ONS)は、2021年4月から11月中旬まで、ワクチン未接種者の死亡率が、2回目のワクチン接種を受けたワクチン接種者と比較して高かったと報告した。しかし、2021年11月末から2022年12月にかけて、この状況は元に戻りました。
ワクチン接種を受けていない人に比べて、3回目のワクチン接種を受けたワクチン接種者の死亡率が高かった。さらに、最近の研究では、2021年の欧州における新型コロナウイルスワクチン接種の接種率と2022年の月間全死因超過死亡との関係性を調査した。
つまり、パンデミック前よりも死亡率が高かったのです。人口規模別に推定した31カ国の分析によると、2021年のワクチン接種量が多かった国では、2022年の最初の9か月間における全死因死亡率がさらに増加した。2021年のワクチン接種率の1パーセント増加は、2022年の月間死亡率0.105%増加と関連していた(95%CI、0.075~0.134)。この関係は、代替要因を調整した後も強いままでした 。
これらは有意な中和抗スパイク IgG および IgA 反応を誘導する可能性がありますが、ファイザー、モデルナ、およびアストラゼネカの 3 つの抗 COVID-19 ワクチンはすべて、SARS-CoV-2 感染に対して一時的にのみ保護されるようです。
Omicron 変異体によってもたらされる画期的な感染率の高さは、既存の予防接種スケジュールによって提供される滅菌防御が最小限であることを示唆しています。
SARS-CoV- 2が免疫学的モニタリングと攻撃を回避するために使用する回避戦略はいくつかあります。これには、インターフェロン合成の障害が含まれます、ナノチューブの構築による体液性攻撃の回避 、合胞体形成によるリンパ球減少症の誘発 。
致死性の COVID-19 症例は、高レベルの IgG4 抗体と関連付けられており、mRNA ワクチンがその合成を引き起こすことも報告されている 。したがって、この問題を徹底的に分析することが重要です。
この論文では、mRNAワクチンによるワクチン接種を繰り返すと免疫寛容機構が生成され、それによって無抵抗のSARS-CoV-2複製が促進される可能性があることを示唆する科学的根拠を提供します。
この耐性の長期的な結果は、宿主の寛容な状態の確立であり、感受性のある個人のmRNAワクチン接種によって引き起こされる慢性感染やその他の意図しない結果を引き起こす可能性があります。
2. 珍しい IgG4 抗体の特徴
IgA、IgE、IgM、IgG など、抗体免疫兵器を構成するいくつかの免疫グロブリンのクラスおよびサブクラスは、基本的に重鎖定常領域の構造によって同定されます。
ヒト免疫グロブリン G (IgG) は、重鎖 (IgG1、IgG2、IgG3、およびIgG4 )の免疫原性に基づいて 4 つのサブカテゴリーに分類されます。
免疫グロブリンのサブクラスは、基本的な生理学的制御、生物全体の局在化、および免疫系エフェクター細胞上の受容体との結合が異なります。
あまり普及していないサブクラスである IgG4 は、平均値 0.35 ~ 0.51 mg/mL で血清中に検出されます。一方、最も一般的なサブクラスである IgG1 のレベルは 5 ~ 12 mg/mL の間で変動します。
IgG4 は、補体系の活性化や抗体の使用を通じて感染細胞を破壊する能力など、その異常な生物学的特性とエフェクター機能の欠損により、抗体構造の受け入れられている理論に従わず、異常な抗体と呼ばれてきました。
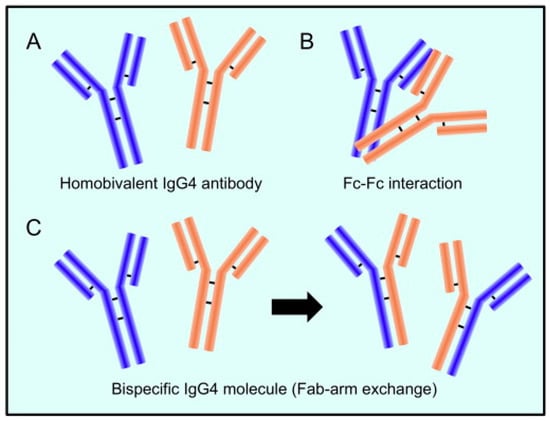
Fab アーム交換としても知られ、IgG4 抗体に特異的な、抗体の半分を別の半分に置き換える反応の背後にあるメカニズムは、過去 20 年間にわたって解明されてきました。
天然の IgG4 結合ジスルフィド結合の還元傾向が高まるため、重鎖は解離し、その後任意に再結合する可能性があり、その結果、ランダムな重鎖と軽鎖のカップルを持つ不均一な IgG4 分子のグループが形成されます (図 1) 。

図 1. IgG4 抗体は特徴的な構造を持っています。
( A )2 つの重鎖と 2 つの軽鎖で IgG4 抗体が構成されます。
( B )1 つの IgG4 分子の Fc フラグメントは、別の IgG4 分子の Fc フラグメントと反応することができます。
( C )半分子が交換されると (Fab アーム交換と呼ばれます)、IgG4 は 2 つの異なる特異性を組み合わせて固有の分子 (二重特異性抗体) を作ります。
IgG4 分子の大部分は、半抗体交換により 2 つの異なる Fab アームを持ち、それらが「二重特異性」となり、特定の抗原に対して機能的に一価になります。
その結果、他の IgG サブクラスとは異なり、流通している IgG4 抗体は抗原と免疫学的複合体を形成できません。IgG4 抗体は、C1q および Fc 受容体に対する親和性が弱いため、理論的には免疫学的活性化の可能性が限られています。免疫複合体の生成は補体系と免疫エフェクター細胞の作用を刺激します。さらに、IgG4 抗体は、同等の特異性を持つ抗体の結合を取り除くことによって、IgG1 または IgE 抗体の炎症作用をブロックできる可能性があります。
「IgG4 関連全身性疾患」という名称は、以前は完全に別個の疾患であると考えられていたいくつかの臨床症状を指します。この病気に関連する臓器のリストは増え続けています。関与する臓器に関係なく、組織生検では重大な組織学的類似性が示されます。ただし、臓器によっても若干の違いがあります。特徴的な病理所見には、広範な線維症、多数の IgG4 陽性形質細胞、および分散したリンパ形質細胞様浸潤が含まれます。
2.1. IgG4: 防御抗体、それとも病原性抗体?
IgG4 の「阻止抗体」としての評判は、免疫系エフェクター反応を誘発する能力が低下していることに由来しています。これは、IgG4 が分子と相互作用する場合、最小限の免疫応答のみが存在することを意味します 。
IgG4 応答は、状況に応じて病原性または防御性のいずれかになります。たとえば、IgG4 は、アレルギーや蠕虫およびフィラリア寄生虫による感染の場合、抗原結合をめぐって炎症性 IgE と競合することで炎症を抑制または停止できるため、保護ブロック抗体とよく呼ばれます。対照的に、IgG4 は癌だけでなく、いくつかの自己免疫疾患において重篤な疾患を引き起こす可能性があります。その二重機能については、次のサブセクションで徹底的に検討します。
2.1.1. アレルギー免疫療法における IgG4 の保護的役割
IgG4 のエフェクター作用の欠如と半抗体交換の現象は、これらの抗体が有害であるかどうか、または永続的な免疫疾患に対する逆調節反応として機能するかどうかについて複雑な考察を引き起こします。
発表された研究によれば、高濃度の抗原特異的 IgG4 は、免疫グロブリン E (IgE) 媒介効果を阻害することにより、アレルゲン特異的免疫療法における満足のいく結果につながります (図2 ) 。
さまざまな側面において、アレルゲンに対する耐性を獲得することは、強力な免疫システムの発達において不可欠なステップです。したがって、アレルゲンに対する長期の脱感作を開発するには、免疫寛容につながる改変されたアレルゲン特異的記憶T細胞およびB細胞応答が関与する経路が利用されます。

2.1.2. IgG4 関連疾患とその病因
IgG4関連疾患(IgG4-RD)は、損傷した組織に多数のIgG4+形質細胞が存在し、すべてではないがほとんどの症例で血清IgG4濃度が高いことにちなんで名付けられた線維性炎症性疾患である。
以前の報告によれば、いくつかの自己抗体が IgG4-RD 患者の血清中に検出されています。さらに、ステロイド療法が通常、IgG4-RD 患者の治療に非常に成功していることはよく知られています。これらの特徴は、この病気の起源が自己免疫であることを示唆しています。抗CD20抗体であるリツキシマブは、最近の研究でIgG4-RD患者において顕著な臨床反応を引き起こし、B細胞と形質芽細胞の大幅な減少を伴った。
これらの結果は、IgG4-RD 個体における IgG および/または IgG4 濃度の増加が有害な役割を果たす可能性があることを示唆しています。
IgG4 は、Fab アームを交換する能力、補体に結合できない能力、Fc 受容体に対する弱い親和性などの生物学的特性により、抗炎症性免疫グロブリンとみなされています。
ただし、IgG4 抗体は、重症筋無力症、特発性膜性糸球体腎炎 、尋常性天疱瘡 (PV)など、一部の疾患では組織を損傷する自己抗体として機能します。
IgG4-RD には以前はミクリッツ病 (MD) 、自己免疫性膵炎 (AIP) 、リーデル甲状腺炎、間質性肺炎、間質性腎炎と診断されていた幅広い疾患が含まれます。前立腺炎、リンパ節腫脹 、後腹膜線維症 (RPF) 、炎症性大動脈瘤 。
また、少なくとも 13 種類の自己免疫疾患の発症にも重要な役割を果たしています。ヒト総 IgG または IgG4 を受動的に注入された実験動物は、これら 13 疾患のうち 5 疾患で症状を発現することが示されており、この抗体の病原性が証明されています。
IgG4 誘発自己免疫は、抗原特異的自己抗体の大部分が IgG4 クラスであり、その濃度が残りの 8 つの疾患の病気の重症度と相関しているという発見によって示唆されています。
例えば、筋特異的キナーゼ(MuSK)に結合する抗体の産生を特徴とする重症筋無力症(MG)は、軸筋と球筋が大きく関与する散発性の筋肉の硬直を特徴としています。病気の特定の段階では、患者のかなりの部分が呼吸補助を必要とします。
2001 年に MuSK 抗体が同定された後、その IgG4 サブクラスの優勢性と力価と疾患の重症度との相関関係が重要な発見であることがすぐに明らかになりました。MuSK MG 患者由来の高純度 IgG4 はマウス筋肉の神経筋接続に付着できましたが、同じ患者由来の IgG1 ~ 3 やコントロール IgG4 には付着できませんでした。この抗体を注射すると、免疫力が低下した動物に筋無力表現型が引き起こされました。これらの試験により、IgG4 の病原性が決定的に証明されました。
がんにおける IgG4 の役割
がん免疫療法剤としてよく知られる免疫チェックポイント阻害剤は、チェックポイントタンパク質が関連するポリペプチドと結合するのを防ぎ、細胞傷害性 CD8+ T リンパ球 (CTL) ががん細胞を攻撃できるようにします。
免疫チェックポイント遮断(ICB)薬には、抗CTLA-4(細胞傷害性Tリンパ球抗原4)および抗PD-1(プログラム細胞死タンパク質1)モノクローナル抗体が含まれます。ICBは、進行期癌患者を含む幅広い種類の癌において治療効果を実証している。残念ながら、治療を受けたがん患者のうち、ICB の治療効果の恩恵を受けているのは 15 ~ 30% のみです。
最も重要なことは、新しい報告では、抗PD-1モノクローナル抗体治療を受けている特定のがん患者は、がんの寛解ではなく急速な疾患進行(超進行性疾患(HPD)としても知られる)を示していることが示されている 。
1つの抗体は IgG4 ファミリーに属し、さらに、悪性黒色腫 、肝外胆管癌 、膵臓癌などの癌は、IgG4 陽性の血漿 B 細胞浸潤と関連付けられています。癌への寄与はほとんど理解されていませんが、画期的な研究により重要な新しい知識が追加されました。Karagiannis et al. [ 48]] は悪性黒色腫を研究し、IL-4 および IL-10 の発現が上昇し、腫瘍組織で局所的に腫瘍特異的 IgG4 が生成されることを発見しました。IL-10 は抗炎症性サイトカインであると考えるのが一般的です。しかし、これは少量の場合にのみ当てはまり、濃度が高くなると炎症促進効果を示します。
カラギアンニスらはまた、癌特異的 IgG1 とは対照的に、癌特異的 IgG4 は癌細胞を識別して破壊するために抗体を使用する 2 つの免疫学的プロセスを活性化できないことも発見しました。
さらに、IgG1 抗体は in vivo モデルで癌の進行を抑制できましたが、IgG4 は抑制できませんでした。IgG4 抗体は腫瘍細胞を直接攻撃できず、IgG1 抗体によって媒介される腫瘍細胞死のプロセスを妨害する可能性があります。
Fc RI による IgG1 の結合と活性化の阻害が、この阻害活性の背後にあるメカニズムです。このような発見は、腫瘍によって誘導されるIgG4合成が腫瘍に対するエフェクター免疫細胞の活性を制限するという、これまで研究されていなかった腫瘍誘導性免疫回避の特徴を示している。
別の実験でも同じ結論に達しました。つまり、IgG4 抗体は癌の免疫回避に重要かつ必要です。食道がん患者のコホートでは、高濃度の IgG4 を産生する B 細胞が悪性細胞で顕著に増加し、患者の血清サンプルでも高濃度でした。IgG4 が多いほど、がんの増殖がより進行することに関連しているようで、どちらもがんの悪性度が高く、予後が不良であると強く関連しています。
IgG4は、インビトロで一部の免疫細胞に存在するFc受容体への結合においてIgG1(図3に示すように)と競合することができることが発見された。この競合により、IgG1 抗体によって媒介される、細胞および補体の細胞傷害性や細胞食作用など、がん細胞に対する典型的な免疫応答が阻害されます。

図 3. B リンパ球から産生される IgG4 を介してがん細胞によって進化する免疫回避の示唆された経路が図式的に示されています。がん抗原に長期間さらされると、B 細胞のクラスが変化し、IgG4 が生成されます。その Fc-Fc 結合特性により、このような強化された IgG4 は、癌結合 IgG および免疫エフェクター細胞上の Fc 受容体と相互作用することができます。がん微小環境で IgG4 が増加すると、その特殊な構造的および生物学的特性により、がんに対する効率的な免疫回避メカニズムが促進されます。ADCC、ADCP、CDC、NK の頭字語は、それぞれ抗体依存性細胞媒介性細胞毒性、抗体依存性細胞食作用、補体依存性細胞毒性、ナチュラルキラー細胞を表します。
がん組織における局所的な IgG4 レベルの上昇は、抗体媒介抗がん反応を妨げ、がんによる局所免疫反応の遮断を助け、がんの進行を間接的に助けます。3 つの別々の免疫強力なマウス モデルがこの理論を裏付けました。IgG4 の局所投与により、移植された結腸直腸腫瘍および乳房腫瘍、ならびに発がん物質によって引き起こされる皮膚乳頭腫の増殖が劇的に加速されることが発見されました。
研究者らはまた、がん免疫療法に使用されるIgG4抗体ニボルマブを検査し、リン酸緩衝食塩水(PBS)およびIgG1治療群と比較して、マウスのがんの発症を劇的に加速させることを発見した。
研究者らは、免疫学的に適格なマウスのモデルを使用して仮説を評価し、そのような抗体によって媒介されるメカニズムをさらに調査しました。
1 つのモデルでは、乳がん細胞の皮下接種部位に非がん特異的 IgG4 を注射しました。他のマウス群(IgG4を含まずにPBSまたはIgG1を注射)と比較して、この群のがん細胞の増殖は劇的に加速し、21日までに著しく大きながん塊を生成しました。
IgG4 はがん細胞の増殖に直接的な影響を及ぼさないため、これらの発見は、がん細胞が IgG4 抗体を利用して局所免疫反応をブロックし、その結果、免疫回避を介して in vivo でがん増殖が可能になることを明確に示しています。これは、PD-1 阻害剤による癌治療と時折関連している最近発見された超進行症候群を説明できる可能性があります。
免疫系は、プログラム細胞死タンパク質 1 (PD-1) 受容体に結合する免疫チェックポイント阻害治療用抗体のおかげで、免疫監視を逃れる可能性のあるがんを検出できます。
しかし、IgG4 抗体は、制御性 T 細胞によって抑制される免疫系の能力を妨げることにより、自己免疫反応を引き起こす可能性もあります。興味深いことに、抗 PD-1 抗体はクラス IgG4 であり、この治療法が諸刃の剣であるという懸念が生じています。例えば、免疫チェックポイント阻害剤を単独または組み合わせて使用している患者は、急性心筋炎の発生と関連しており、時には致死的な結果を伴う。
3. さまざまなワクチンによって誘導される IgG4 抗体の役割
文献を広範に検討した結果、IgG4 抗体産生を誘導するのは mRNA ワクチンだけではないことが示されました。HIV、マラリア、百日咳のワクチンも同様の反応を引き起こしました。全体として、IgG4 抗体へのクラススイッチを決定する重要な要因は 3 つあります。それは、過剰な抗原濃度、ワクチン接種の繰り返し、および使用するワクチンの種類です。
3.1. ワクチン中の過剰な抗原濃度
BNT162b2 と比較して、mRNA-1273 ワクチンは、延長された IgG4 応答を誘導する優れた能力を持っていました。生成されるスパイクタンパク質の量と持続時間は、BNT162b2 ワクチン (30 μg) と比較して mRNA-1273 ワクチン (100 μg) の mRNA 濃度が高いことによって影響を受けると考えられます。興味深いことに、mRNA ワクチンの中でも、mRNA-1273 ワクチンは、新型コロナウイルス感染症に感染していない個人において抗 S1 血清 IgG4 濃度の増加を引き起こし、これまで知られていなかった病原体防御への影響をもたらしました。アデノウイルスベースのワクチンを受けた非感染者は、270日目まで、この長期持続するIgG4反応を示さなかった。
低抗原濃度で注射されるように設計されたワクチンに関連する問題は、免疫学的反応が欠如する可能性があることであり、伝統的に、特に広範囲の感染症に対して根強い「多ければ多いほど良い」という考え方と強いつながりがあった。
ワクチンによる防御の信頼できる免疫予測因子が存在しない疾患(ヒト免疫不全ウイルス(HIV)、結核(TB)、C型肝炎ウイルス(HCV)など。
大量(用量濃度)または同じ抗原による繰り返しの免疫(ワクチン)は、特異的な T 細胞寛容(末梢 CD4)を誘導し、その後免疫応答を阻害する傾向があります。しかし、液性免疫と細胞性免疫の両方の協力に必要な溶解性感染症には、初回免疫における高抗原用量が推奨されているのに対し、追加免疫には低抗原用量が推奨されている。
用量漸増技術は通常、臨床第 I 相ワクチン研究で最良の反応を生み出す用量を見つけるために使用されます。これは、既知の防御の免疫学的指標が存在しない疾患にとっては理にかなっていますが(したがって、強力な反応はおそらく無反応よりも優れています)、許容され、陽性反応をもたらした最大用量が、次の第 II 相で採用されることがよくあります。 Ⅲ 調査。しかし、このアプローチに対する重要な議論は、いくつかの主要な発見によって裏付けられています:
(1) 過剰な量の抗原が注射されると、細胞死が引き起こされ、特定のグループの T 細胞が失われる可能性があります。この現象はクローン欠失として知られています。
(2) 長期間の抗原曝露の結果として免疫寛容が生じる可能性があります。T 細胞は、感染症やその他の異物を検出して除去する免疫システムの重要な部分です。しかし、これらの T 細胞は、ワクチン接種の繰り返し中など、高濃度の抗原に曝露されると、脱感作され、繰り返しの曝露に反応する能力を失う可能性があります。免疫寛容は、感染症の持続や自己免疫疾患の発症を引き起こす可能性がある状態です。
(3) ワクチンが高濃度で投与されると、T 細胞は「最終分化」として知られるプロセスを経る可能性があり、この時点で T 細胞は高度に特殊化され、分裂および増殖する能力を失います。その結果、免疫系が疲弊し、その後の病気に対してうまく防御できなくなります。これは、ワクチン接種の予防効果を損なう可能性があるため問題です。免疫学的防御の利点と免疫枯渇による潜在的な欠点のバランスをとるために、ワクチンの理想的な用量を慎重に決定することが重要です。
(4) 有害な結果は、より多くの用量を投与されたグループで発生する可能性が高くなります。
(5) 抗原と T 細胞受容体または抗体との反応の強さはアビディティと呼ばれます。結合力が高い場合、免疫応答は標的抗原を特定して除去する際により効果的になります。しかし、抗原の用量が多いと、免疫系の細胞が脱感作され、防御がうまくいかなくなる「免疫枯渇」を引き起こす可能性があります。その結果、ヘルパー T 細胞と抗体の結合力が低下し、標的抗原に対する免疫応答が損なわれる可能性があります。強力で効果的な免疫応答を確立するには、免疫療法で利用される理想的な抗原用量を徹底的に評価することが重要です。
ビレスコフらは、いくつかのエフェクター能力によって判断される品質と、動物実験とヒト実験の両方での予防効率の両方において、より低いワクチン抗原用量が T 細胞からのより多くの陽性反応をもたらした事例の証拠を提供し、ワクチン抗原用量を減らすことの重要性についての議論を提示しました。
一部のモデルでは最適な保護を実現します。彼らはまた、特に T 細胞ワクチン接種の専門家に対して、時には確実に少ない方が効果があることを覚えておくよう奨励しました。
結論として、抗原の用量濃度、反復曝露、および IgG4 産生の誘導の間に関連性はあるのでしょうか? それとも、IgG4 濃度の上昇は遺伝的素因によるものでしょうか? ワクチン接種者の約半数が 2 回目の mRNA 接種後に IgG4 濃度の大幅な増加を示したのを見ると、このような増加が遺伝的素因によって引き起こされたものではないことは明らかです。
さらに、モデルナとファイザーは初回ワクチン接種と追加ワクチン接種に同じ抗原用量を使用したが、これは追加接種には低抗原用量が推奨されるというワクチン学のパラダイムに矛盾する。
3.2. 繰り返しのワクチン接種
3.2.1. 新型コロナウイルスワクチンの繰り返し接種
研究者らは、最初の 2 回の mRNA ワクチン投与の直後に、炎症促進性サブクラス IgG1 および IgG3 が IgG 応答を支配したことを報告しました。それにもかかわらず、2回目のファイザーワクチン接種から数カ月後、3回目のmRNA注射および/またはSARS-CoV-2変異体による新たな感染によって、スパイク特異的抗体はさらに強化された。
スパイクタンパク質に対して生成されたすべての IgG 抗体のうち、IgG4 が最も増加し、2 回目のワクチン接種直後の 0.04% から 3 回目のワクチン接種後の 19.27% まで着実に増加しました。
このような IgG4 レベルの上昇は、アデノウイルスベクターをベースにした同じタイプまたは異なるタイプの SARS-CoV-2 ワクチンを受けた個人では観察されず、この研究では、mRNA ファイザーワクチンが原因となった唯一のワクチンであることが証明されました。
この反応の驚くべきことに、2回目の接種から7か月後、ワクチン接種者の約半数の血清中のIgG4レベルは検出下限を超えました。IgG4抗体濃度の上昇が利用された相同mRNAワクチン接種スケジュールに限定されたものであるかどうかを判断するために、研究者らは、ファイザー社とアデノウイルスベクターを使用した、似て非なる予防接種スケジュールに対する免疫系の反応能力を評価した独立グループの血清を研究した。アストラゼネカのベースのワクチン、抗スパイク IgG4 抗体は、2 回目のワクチン接種から 5 ~ 6 か月後、BNT-BNT グループの血清の 50% で再び検出されましたが、他の 2 つのワクチングループの 51 個の血清サンプルのうち 1 個のみで検出されました。重要なことに、3回目の追加免疫後、実質的にすべてのワクチン接種者でIgG4抗体レベルの大幅な上昇が検出されました。
この点に関して、従来のワクチン接種スキームに従って、ファイザー製新型コロナウイルスワクチンのデルタおよびオミクロン変異体に対するマウスの血清中和効果が、多数回の追加接種後に劇的に減少することが最近証明された。
抗原刺激を繰り返すと、CD8+ T 細胞が疲弊することが報告されています。これらのブースターはまた、CD4+ および CD8+ T 細胞反応を大幅に減少させ、これらの T 細胞におけるプログラム細胞死タンパク質 1 (PD-1) およびリンパ球活性化遺伝子 3 (LAG-3) の産生を増強しました 。
長期にわたるワクチン接種は胚中心の正常な発達を低下させ、RBDに特異的な記憶B細胞の生成を妨げた。この研究はさらに、RBDワクチン追加免疫を長期間続けると、免疫抑制サイトカインIL-10の濃度とCD25+Foxp3+CD4+Treg細胞の割合が増加することを明らかにした。従来の SARS-CoV-2 ワクチンの免疫学的保護を提供する能力は、過剰ワクチン接種によって大きな影響を受ける可能性があります。このような事態が発生した場合、新たに新型コロナウイルス感染症と診断された人、またはすでにウイルスに再感染した人は、より重篤な症状を呈する可能性があります。この概念は、長期のブースター免疫投与に対する体液性免疫反応と細胞性免疫反応の両方の耐性を確認した後に提案されました 。
3.2.2. HIVワクチンの繰り返し接種
Chung らによる研究。
HIV ワクチン接種試験のシナリオにおける同様の HIV ワクチンによる反復予防接種を対比させた。1 つのワクチン (RV144) によってもたらされる防御 (31.2%) は、IgG1 および IgG3 抗体の産生と関連していると著者らは説明しましたが、他のワクチン (VAX003) の防御は無視できるほどであり、IgG3 抗体の産生と関連していました。
複数回のワクチン接種後の IgG4 抗体 。
VAX003 ワクチンは IgG4 レベルを上昇させ、これは歴史的に免疫学的効率の低下と関連付けられてきたため、研究者らは、IgG4 産生が単に機能的応答の障害に関連して誘発されただけなのか、それとも不適切に組織化された応答に大きく寄与しているのかを知りたいと考えていました。両方の試験の 16 の同様のサンプルから IgG4 抗体を除去した場合、VAX003 サンプルではバルク IgG と比較して ADCP 活性の大幅な増加と ADCC が大きくなる傾向が観察されました。
これらの発見は、IgG4 抗体がアドホックな反応の発生にのみ関与するのではなく、抗体の Fc エフェクター機能を直接低下させる可能性があることを示しています。7回のタンパク質ワクチン接種後に大量のIgG4を含む単機能性抗体を生成したVAX003と比較して。したがって、いくつかのワクチン接種およびワクチンプロトコルは持続的な抗体反応を引き起こす可能性がありますが、これらの IgG4 抗体は IgG1 および IgG3 サブクラスほど効果的ではない可能性があります。
結果として、完全に効率的な抗体 (IgG3) から IgG4 への IgG サブクラスの変更は、HIV ワクチンの成功に対する重要な障害となる可能性があります 。
このような所見は、mRNAワクチン接種を繰り返した後に最近報告された所見と類似している。この IgG4 クラスの変化は、補体沈着および抗体依存性の細胞食作用を促進するスパイク特異的抗体の能力の低下に関連していました。さらに、ワクチン誘導性 IgG3 抗体は、抗体依存性細胞媒介性細胞傷害 (ADCC) や抗体依存性細胞食作用 (ADCP) などの免疫機能を改善しましたが、ワクチン誘導性 IgG4 抗体はこれらのプロセスをブロックしました。
同様に、HIV 研究では、血清から IgG4 抗体を除去すると、Fc 媒介エフェクター活性が大幅に上昇し、IgG4 抗体の非防御的な役割が確認されました。VAX003群におけるIgG4の異常に高い産生は、適切なアジュバント刺激の欠如下で高濃度の抗原を含むワクチンを7回繰り返し注射したためである可能性があり、これが不均衡なB細胞受容体活性化に至った可能性がある。
これらのデータから、VAX003 グループの IgG4 産生は繰り返しの追加免疫 (RV144 グループでは 4 ラウンドであるのに対し、7 ラウンドの免疫) に関連しており、HIV 感染からの防御力が低下していることは明らかです。さらに、この IgG4 へのクラススイッチは、Fc を介した抗ウイルス応答の障害により、画期的な感染を促進する可能性があります。これは、Fc媒介エフェクター作用がウイルス排除に不可欠であることを考慮すると、IgG4サブクラスの増加が感染時のウイルス持続期間の延長につながる可能性があるという考えを裏付けるものである。
3.2.3. マラリアワクチンの繰り返し接種
メロゾイト表面タンパク質 1 (MSP-1)、175 kDa 赤血球結合抗原 (EBA-175)、および頂端膜抗原 1 (AMA-1) は、熱帯熱マラリア原虫に対する自然免疫応答の 3 つの主要な目的です。マラリアの原因となる寄生虫。したがって、これらの抗原に対する抗体が臨床疾患に対する保護剤として機能するのか、それとも曝露マーカーとしてのみ機能するのかは不明でした。
モザンビークの生後5、9、12、24ヵ月の小児302人のグループにおいて、高度に特異的な検査を用いて熱帯熱マラリア原虫に対する抗体反応が判定された追跡期間中のマラリアの発生率は、EBA-175抗原に対するIgGサブタイプ反応と異なる相関があることが判明した。
熱帯熱マラリア原虫抗原によって誘発される抗体アイソタイプが必須であると考えられているため、IgG の予防効果は非中和サブタイプ (IgG2) (IgG2 および IgG4) ではなく中和サブタイプ (IgG1 および IgG3) に起因すると考えられています。 _ _ _ _ _ EBA-175 に対する IgG1 の反応性は、生後 1 年間一貫していましたが、翌年には上昇しました。
IgG4 反応性は最初の 1 年では最小限でしたが、2 歳までに大幅に増加しましたが、IgG3 反応性は研究期間を通じて中程度のままでした。IgG3 の反応性は常に安定していましたが、IgG4 は最初の 1 年は低かったものの、2 歳になると大幅に増加しました。この研究は、生後5ヵ月と12ヵ月の個人の抗体反応に焦点を当て、5ヵ月から12ヵ月と12ヵ月から24ヵ月という2つの異なるリスク期間におけるマラリアの発生率を調査した。彼らの分析では、EBA-175 抗原に対する IgG サブクラスの明確なパターンに気づきました。中和 IgG1 および IgG3 として知られる特定の抗体の濃度が高いと、2 年目にマラリアに感染する可能性が低下することに関連していました。IgG1 のレベルが 2 倍になると、マラリアのリスクが約 50% 減少しました。
非中和 IgG4 レベルが 2 倍になると、マラリアに感染する確率が約 3 倍増加することに注意することが重要です。生後 24 か月まで、IgG1 と IgG3 はそれぞれ 51% と 56% の保護効果を示しました。しかし、IgG4は、この年齢層全体でマラリア感染のリスクの上昇と関連していた。興味深いのは、別の研究でも、高い IgG4 レベルと感染症およびマラリア増悪のリスクの増加との関連性が発見されたことである。これは、IgG4 が単球または他のエフェクター細胞によって引き起こされる IgG2 依存性細胞の細胞毒性をブロックすることを意味します。IgG4 レベルとマラリア感染の可能性は両方ともマラリア伝播の季節と関連していました。IgG4 濃度が感染期を通じて大幅に増加し、その増加が高齢者よりも若年者の方が大きかったという事実も、IgG4 の遮断機能を裏付けています。さらに、IgG4 は、in vitro で IgG1 および IgG3 による感染赤血球のオプソニン化を防ぐことが実証されています。
3.3. 使用されるワクチンの種類
IgG4 反応は、破傷風トキソイド (TT) ワクチンや呼吸器合胞体ウイルス (RSV) など、多数回接種した後であっても、他のワクチンではまれに報告されています。これらの結果は、IgG4 クラススイッチは、他のウイルスや病気に対する予防接種による繰り返しの抗原曝露の一般的な結果ではないという提案を裏付けています。麻疹ウイルスの自然感染では特異的な IgG4 抗体が生成される可能性がありますが、ヒトサイトメガロウイルス (HCMV) などの持続ウイルス感染では大量の IgG4 抗体は生成されません。
最近発表された研究では、長期的な IgG4 応答は mRNA ワクチンによって生成されるが、アデノウイルスを使用したワクチンによっては生成されないことがわかりました。興味深いことに、2 つの mRNA ワクチンと、mRNA ブースターを含む 1 つの AZD1222 (AstraZeneca) ワクチン接種、特に mRNA-1273 ワクチンが、非感染対象において長期の抗 S1 IgG4 反応を引き起こしたことは注目に値します。
しかし、研究者らは、非感染者にAZD1222ワクチンを2回投与した後、270日目までこの上昇を検出できず、mRNAワクチンのみが270日目まで検出可能で持続的なIgG4反応を誘導したことを示した。 (ワクチン接種前)感染後、mRNA注射後でもIgG4は上昇しなかった。これは、IgG4レベルが高い人は、新型コロナウイルス感染症に感染する前にmRNAワクチンで免疫を受けた未感染の人であることを示唆している。
文献をさらに分析すると、ウイルスの一部を使用したワクチンのみがIgG4レベルの増加を引き起こしたことが示されています(それぞれ、mRNAワクチンの場合はスパイクタンパク質、HIVの場合はgp120タンパク質、マラリアワクチンの場合はEBA-175抗原)。 。
興味深いことに、Buhre らは、アストラゼネカのアデノウイルスベクターベースのワクチンが IgG4 レベルのそのような増加を誘発しないことを発見しました。
さらに、他の研究では、無細胞ワクチン(aP)が全百日咳ワクチン(wP)ではなくIgG4抗体産生を誘導することが示されており、これも免疫障害に関連していました。wP ワクチンを注射された小児は、aP ワクチンを注射された小児よりも合計および IgG1+ 形質細胞反応が大きいことが実証されました。
世界感染症・免疫障害学会(WAidid)会議で発表された結果によると、初回予防接種時にaPワクチンを受けた小児は、wPワクチンを受けた小児よりもIgG4レベルが有意に高かった。IgG4 抗体は補体系を活性化することができず、その結果、抗体依存性の食作用を引き起こすことができないため、百日咳ワクチンの有効性のためには、IgG4 よりも IgG1 抗体の方が効果的である大量の抗体兵器を生成することが重要です。
ーーーーーーーーーーーーーーーーー
ブログの字数制限を超えてしまうため、2記事に分けて投稿します。
続きもお読み下さい。
診療所の患者さんへ
土曜日はビストロヒマワリのお弁当の配達があります。
欲しい方は前日金曜日の16時までにお電話でお申し込み下さいね![]()
06-6941-0919
メニューはコチラから↓
コロナ後遺症、ワクチン後遺症、イベルメクチンに関するお問い合わせはコチラへお願いします↓
コロナ関連・ワクチン後遺症について
コチラからお問い合わせ頂いても構いません。
お問い合わせの際は「ブログを見た」とお伝え下さい。
患者さんのリクエストで復活させた
化粧品と発酵素するりの記事は
コチラ![]()
便通・腸を整えて美肌を目指す 元皮膚科・現役肛門科の女医が教えるキレイ術
2020年12月25日に出版し、おかげさまで9刷目となり累計発行部数が3万部を超えるベストセラーになりました![]()
オシリを洗っている全ての人に届けたい。
お読み頂けると幸いです。
公式LINEでも情報発信中