新型コロナに感染(PCR検査陽性ではない)し発症すると、免疫力が損なわれる事が分かっています。新型コロナの毒性はスパイクタンパク質にありますが、このスパイクタンパクには、今まで知られていたコロナウイルスには見られなかったスーパー抗原があり、それが免疫力を損なっているようです。そして、ワクチンはこのスパイクタンパク質をそのままコードして作られています。
その様なこともあり、ワクチンには免疫力を損なうことの他、様々な疑問や不可解な事が多く指摘されていますが、政府もマスコミもそのことは全く報じていません。
今回は新型コロナウイルス=SARS-COV2が、スーパー抗原を持っているという論文について書いてみます。
スーパー抗原とSARS-CoV-2
要旨
SARS-CoV-2には、他のSARSや常在コロナウイルスには見られない、少なくとも一つのユニークなスーパー抗原様モチーフが存在すると考えられる。スーパー抗原は、免疫系を過剰に興奮させる可能性のある強力な抗原である。SARS-CoV-2は、スーパー抗原の生物学的および臨床的影響の多くを引き起こす。再感染と免疫力の低下という観点から、スーパー抗原、スーパー抗原様、またはスーパー抗原性宿主反応を引き起こす可能性のある、広く循環する空気感染病原体の影響をより良く理解することが重要である。
免疫力の低下は様々な既往症を持つ人にとって、悪影響を意及ぼすことは容易に想像出来ます。過去記事で何度かHIVウイルスとAIDS(後天性免疫不全症候群)について書いていますが、SARS-COV2とHIVは似ている所があり、共に免疫不全を引き起こします。今後HIVによるAIDSが懸念されると海外では報道されていますが、これも日本では全く話題になっていません。海外で報道されている内容はAIDSというよりもVAIDS=ワクチンによる免疫不全症候群が懸念されています。
*次に来るのはHIVなのかVAIDS(VaxxによるAIDS)なのか
*ワクチンによる免疫システム崩壊のカバーストーリーとして「HIV変異体」説を押し付けるメディア
*HIVとAIDSについての情報がまとめられた報道を読んで思うこと
現在は行動制限も解除され、ウクライナ問題が大きく取り上げられるようになり、コロナ騒動は以前ほど騒がれなくなりましたが、4回目のワクチン接種に向け、まだまだ継続中です。コロナ騒動の真相が徐々にバレつつあるので、ウクライナ問題はその煙幕にもなっているようです。
今回のコロナ騒動が終わっても、プランデミックとワクチンビジネス、そしてワクチンパスポートと社会管理体制構築の流れは続くと思いますので、コロナ騒動を検証し理解しておくことは、今後起きるであろう事象に対応するためにも重要だと思います。
最後に論文を全文転載します。
文字の装飾は私が行なっています。用語の解説を青文字で挿入しました。
ーーー以下 転載ーーー
1 Panres Pandemic Research、ニューポートTF10 8PG、英国
2 ジョンズホプキンスブルームバーグ公衆衛生大学院、ジョンズホプキンス大学、ボルチモア、メリーランド州21205、米国
受領:2022年2月10日 / 改訂:2022年3月3日 / 承認済み:2022年3月22日 / 公開日:2022年3月23日
要旨
SARS-CoV-2には、他のSARSや常在コロナウイルスには見られない、少なくとも一つのユニークなスーパー抗原様モチーフが存在すると考えられる。スーパー抗原は、免疫系を過剰に興奮させる可能性のある強力な抗原である。SARS-CoV-2は、スーパー抗原の生物学的および臨床的影響の多くを引き起こす。再感染と免疫力の低下という観点から、スーパー抗原、スーパー抗原様、またはスーパー抗原性宿主反応を引き起こす可能性のある、広く循環する空気感染病原体の影響をより良く理解することが重要である。潜在的な超抗原性病原体の広範な伝播を可能にする政策をとる政府がとっている長期的なリスクをよりよく理解し、その病原体に繰り返しさらされた場合の影響から守るために必要なワクチン接種と公衆衛生政策をより明確に定義するための緊急研究が必要である。
1. スーパー抗原とは何か?
スーパー抗原という用語は1989年に作られ [1]、T細胞受容体(TCR)とMHCクラスII分子との架橋によってT細胞を過剰に刺激するタンパク質を定義したものである。B細胞スーパー抗原の発見により、その定義は拡大された [2]。スーパー抗原は一般に、リンパ球プールの5%以上と抗原受容体を介した相互作用を持つ分子と定義される[3]。
簡単に言えば、スーパー抗原は、免疫系をオーバードライブさせ、ナイーブT細胞プールの30%までを刺激することができる強力な抗原である [4,5] 。スーパー抗原とT細胞との反応は、アレルギー、炎症、細胞傷害性、T細胞の欠失、自己免疫など、様々な結果をもたらす可能性があります[6,7,8]。スーパー抗原はまた、無関係な抗原に対するワクチン接種後の記憶細胞の反応を損ない、記憶細胞の活性化に拮抗することが示されている[9]。
ペプチドとは、アミノ酸が一本の鎖状につながった集合体の総称です。ですから、くっつくアミノ酸の種類と数によって多様な種類が存在し、それぞれに機能性が生まれたりします。そして数百~数千がつながると、たんぱく質となり、筋肉や内臓、骨といった組織を構成するようになります。つまり、ペプチドはたんぱく質とアミノ酸の中間的な存在であるといえます。
免疫学では、抗原(Ag)は、特定の抗体またはT細胞受容体に結合できる分子または分子構造または任意の異物粒子または花粉粒。
体内に抗原が存在すると、免疫応答が引き起こされる可能性があります。
同じスーパー抗原でも、様々な宿主反応を引き起こすことがある。毒素性ショックは、特定の超抗原と結合する特定の MHC(主要組織適合性複合体) クラス II ハプロタイプを持つ個体では、結合親和性の低いハプロタイプを持つ個体と比較して、より深刻に発症することが示されている [10].反応は環境因子にも影響されることがある。例えば、細菌とウイルスの同時感染は、スーパー抗原の効果を増大させることが示されている [11]。スーパー抗原は中枢神経系機能に影響を与え、神経疾患 [12,13,14] 及び心血管機能障害 [15,16] の発症に関与していることが示されている。
スーパー抗原は、MHCクラスIIおよびT細胞受容体分子と多様な相互作用を持ち、多くの異なる相互作用表面および化学量論が関与している[17,18,19]。スーパー抗原に加えて、スーパー抗原の分類から外れたメカニズムを用いてリンパ球を活性化するスーパー抗原様タンパク質が存在する [20]。スーパー抗原様タンパク質は、血小板の活性化を通じて、血栓症や出血性合併症の誘発に関与しているとされています[21,22]。
SARS-CoV-2は、スーパー抗原の生物学的および臨床的影響の多くを引き起こし、再感染と免疫力の低下という状況において、スーパー抗原、スーパー抗原様、またはスーパー抗原的な宿主反応を引き起こす可能性のある、広く循環する空気感染病原体の影響をより理解することが重要であると我々は考えています。
2. デング熱からの教訓
デング熱感染時のTリンパ球の活性化は、デング出血熱(DHF)の発症に寄与していると考えられています[23]。実際、デングウイルス(DENV)は、T細胞の活性化[23]、神経学的合併症[24]、自己免疫[25]など、COVID-19で見られる臨床的特徴のいくつかを引き起こします。DENVが誘発する内皮細胞、血小板、凝固因子に対する自己抗体は、それらの異常な活性化または機能不全につながる[25]。DENV感染の小児におけるTCR Vβ遺伝子の使用に関する研究では、デング熱は超抗原ではなく、むしろ従来の抗原であると結論づけています[23]。この研究の著者は、この発見には限界があると警告していますが、DENV はスーパー抗原によく見られる宿主反応を引き起こす従来型の抗原であることは広く受け入れられています。
従来の抗原でも、超抗原的な宿主応答を引き起こすことができる。DENV血清型2感染に対するヒト内在性レトロウイルス(HERV)の反応に関する最近の研究では、感染中の発現に有意な差異があることが判明した[26]。HERVsは、おそらく歴史的に外来ウイルスの取り込みによって生まれたヒトゲノムの構成要素である[27]。HERVsは重要な生物学的機能を果たしているが、自己免疫や癌の発生にも関与している[28]。ある種のウイルス感染は、HERVのアップレギュレーションと自己免疫を誘発することが示されている[29]。HERVは、超抗原として働くタンパク質を提示することができる [30]。エプスタイン・バー・ウイルス(EBV)は、スーパー抗原をコードするHERV-K18をトランスアクチベートすることが示されている[31]。このことは、臨床的な意味を持つかもしれない。例えば、HERV-K18は若年性関節リウマチの患者の末梢血で有意に上昇している[32]。
※EBウイルス(エプスタイン・バー・ウイルス)
ヘルペスウイルスのひとつです。大部分の日本人は、乳幼児期に感染し、多くは症状が出ないため感染に気付きません。思春期以降に初めて感染すると、伝染性単核球症と呼ばれる発熱やのどの痛み、リンパ節の腫れなどの症状が一時的にみられることがあります。また、EBウイルスは、バーキットリンパ腫など一部の悪性リンパ腫や、上咽頭がんの発生と関連があることが明らかになっています。
※ERVK -18遺伝子の要約
レトロウイルスエンベロープタンパク質は、初期感染時に受容体認識と膜融合を仲介します。内因性エンベロープタンパク質は、進化中に元の機能を維持、喪失、または変更した可能性があります。このエンベロープタンパク質はスーパー抗原特性を持っています。
HERV遺伝子座は、様々なウイルス感染によってアップレギュレートされ、一見、効果的な自然免疫応答の一部として機能しているように見えるが [33]、応答の機能不全がスーパー抗原をトランザクタイズし、免疫カスケードや自己免疫の引き金になっている可能性もある。実際、COVID-19患者では、HERV-Kの一過性の上昇[34]、HERV-Wの長期の上昇が見つかっている[35,36]。HERV-Wエンベロープタンパク質(HERV-W-env)は、スーパー抗原の特徴を持つT細胞応答を誘発することが示されている[37]。
3. スーパー抗原とT細胞機能障害
スーパー抗原は、未成熟および成熟CD4およびCD8 T細胞に対して、それぞれ異なった作用を及ぼす(図1)。スーパー抗原は胸腺細胞や未熟なT細胞を枯渇させるが、成熟した抗原経験豊富なCD4およびCD8を過剰に刺激することができる[38]。スタフィロコッカル・エンテロトキシンB(SEB)スーパー抗原による過刺激の後、T細胞は「アネルギー」として知られる無応答状態に陥り、反応しなくなり、時にはその後アポトーシス、つまりプログラムされた細胞死に陥ることもあります [39,40] 。スーパー抗原は、MHC IIによってCD4に影響を与えるだけでなく、サイトカインを介したバイスタンダー活性化やTCRの類似Vβ遺伝子セグメントから、ナイーブT細胞の分化やCD8メモリー細胞の刺激を引き起こす可能性がある[41]。抗原非依存的な活性化、すなわちCD8 T細胞のバイスタンダー活性化は、ウイルス感染の結果としてよく研究されている[41,42,43]。
※アネルギー=免疫不応答状態
健康人に存在するCD4陽性制御性T細胞が自己免疫反応を抑える
CD4陽性制御性T細胞注1)が自己免疫反応(自己免疫疾患)を回避するために自己に反応するCD8陽性T細胞に安定的な免疫不応答状態(アネルギー)を誘導することを明らかにしました。
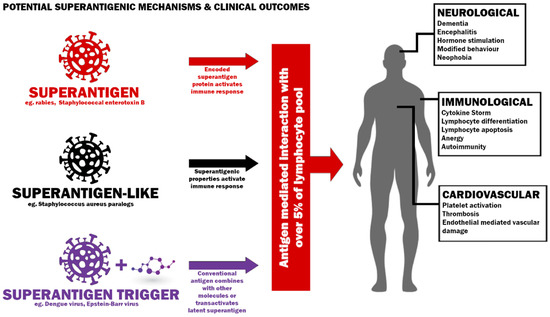
図1. 超抗原性宿主反応を誘導する潜在的なメカニズムと考えられる臨床結果。
SEBスーパー抗原は、in vivoでウイルス特異的CD8 T細胞を、ある場合には直接TCRに関与させ、またバイスタンダー効果の両方で活性化する[44]。このバイスタンダー刺激は、in vitroでも明らかである[44]。興味深いことに、スーパー抗原刺激によって引き起こされるT細胞死は、TCRの直接関与によって活性化されたT細胞よりも、バイスタンダー効果によって活性化されたT細胞において最も顕著である[45]。スーパー抗原がT細胞受容体β鎖あたりを直接刺激するCD8 T細胞は、その細胞傷害性機能を保持している[46]。バイスタンダー効果による抗ウイルス記憶の削除の可能性は、思春期以降の胸腺の退縮を考慮すると、微生物のクリアランスを損なう可能性があるため、調査が必要である [47]。
スーパー抗原に慢性的にさらされると、T細胞は絶えず刺激され、アネルギー状態と過剰刺激状態の間で永久に維持される可能性がある。さらに、ナイーブT細胞はバイスタンダー効果によって活性化され分化することができるので、胸腺の退縮によって新しいナイーブT細胞が生まれにくい人のリンパ組織にナイーブ細胞が移動し、末梢血でナイーブT細胞の枯渇が観察されることがある [47, 48]。この効果は、一部のロングCOVID患者におけるナイーブT細胞の少なさを説明できるかもしれない [49]。ナイーブT細胞の消失は、免疫の老化と機能不全の決定的な指標である。T細胞は、免疫反応の制御に役立ち、癌や感染症からの抗原に反応して最も高い膨張能力を持つ[50,51,52]。
4. スーパー抗原と自己免疫
スーパー抗原は自己免疫疾患の発症に関与している [53,54,55,56,57,58] 。内因性の宿主および微生物エピトープに対して交差反応を示すT細胞クローンが刺激され、自己抗原を含む組織に移動することがあり、このメカニズムはリウマチ熱の病因に関与していると考えられている [59,60].自己免疫疾患の患者は、罹患した臓器や末梢血でそのようなT細胞の増加を示す[5]。超抗原は、B細胞のMHCクラスII分子とT細胞のTCRを橋渡しすることにより、自己抗体産生を刺激する[61]。欠失や自己免疫が起こるかどうかは、投与量、持続性、宿主のハプロタイプ、サイトカイン反応の重症度の関数であるようだ [62]。
スーパー抗原への持続的な皮下曝露は、マウスにおいて全身性エリテマトーデス(SLE)を模倣した全身性炎症疾患を引き起こすことが示されている[63]。スーパー抗原は、SLEを誘発したり、悪化させたりすることが示されている[64]。興味深いことに、HERV-Eは、SLEに関与していることが分かっている[65,66]。HERV-Eは、COVID-19患者の気管支肺胞洗浄液でアップレギュレートされていることが判明しています[67]。
※アップ‐レギュレーション【up regulation】 の解説
神経伝達物質やホルモンなどへの応答能が増大すること。それらの物質や信号が減少することで、受容体の数が増加したり、感受性が過敏になったりして生じる。上方制御。上方調節。
インスリン依存性糖尿病(IDDM)は、素因となる遺伝的背景に作用する未知の環境因子によって引き起こされるT細胞媒介性の自己免疫疾患であるが、HERV-W-envアップレギュレーションの形でのスーパー抗原様暴露が、膵臓のマクロファージの採用とβ細胞の機能不全に関与している証拠がある[68]。HERV-W-envに対する抗体は、IDDMに罹患しやすい、または罹患している若者において、従来のIDDM抗体に先行または重複している[69]。
5. 超抗原性、超抗原様病原体、超抗原トリガーとしてのSARS-CoV-2
SARS-CoV-2に関する最近の研究では、Long COVIDを持つ個人におけるナイーブT細胞およびB細胞の枯渇を含む軽度から中等度の感染後の免疫機能障害を発見し [49]、単一細胞アトラスでは、HIVよりもSARS-CoV-2感染においてナイーブT細胞の枯渇と高いレベルのアポトーシスT細胞も発見した [70] ことに留意されたい。SARS-CoV-2感染後の自己抗体 [71,72] 、MIS-Cの提示 [73] 、T細胞の活性化と枯渇 [74] 、IDDMの増加 [75] に関する知見と合わせると、これらはスーパー抗原を示唆するものである。特に、SARS-CoV-2は急性感染後数ヶ月間体内に留まることが判明しているため、その役割と長期的な影響についてさらなる研究が必要である [76,77,78,79,80,81,82]. SARS-CoV-2の超抗原性は、MIS-Cに関与している[83]。スーパー抗原を介した T 細胞活性化の特徴である可変アルファ鎖と組み合わせた TRBV11-2 遺伝子を持つ T 細胞の拡大が、MIS-C 患者のいくつかの研究において報告されている [84,85].
https://www.jst.go.jp/crest/immunesystem/result/04.html
注8) アポトーシス(細胞死)
外傷性ストレスで起こる細胞死ではなく、細胞内に備わる分子機構により誘導される、管理・調節された細胞死。
注9) ナイーブT細胞
T細胞は胸腺においては自己抗原を弱く認識して生存シグナルを受け発達し胸腺の外に出た段階でナイーブT細胞と呼ばれる。胸腺の外に出るとナイーブCD4陽性T細胞は病原体などの抗原を認識し、病原体の種類や周囲の環境に応じてエフェクターT細胞へと分化誘導され、最適の免疫応答を引き起こす。
Brodinは、MIS-C(小児多系統炎症性症候群)のエネルギー配分仮説を提唱し、最大限の抵抗力よりも疾患耐性を選択することを示唆している。つまり、小児は軽症で無症状である可能性もあるが、ウイルスのクリアランス効率が低く、その結果、あるレベルのウイルス持続が起こりやすく、おそらくMIS-Cのスーパー抗原媒介免疫活性化などのウイルス持続に関連した他の状態にもなりやすいのだ [86].SARS-CoV-2の超抗原的特性がなぜ成人に適用されないのか、特にすべての年齢層における臨床的・生物学的症状を考えると、成人と小児の超抗原曝露に対する反応の既知の違いを反映しているのではないかと疑問である。実際、MIS-A(成人の多系統炎症性症候群)はSARS-CoV-2感染の結果として成人に発現し[87]、川崎病のまれな例は成人に観察される[88,89]。
※小児多系統炎症性症候群( MIS-C )
2020年5月にコロナ感染歴のある子どもに川崎病の症状がみられることが欧米で相次いで報告されました。新型コロナウイルスは血管親和性が強く、全身の微小血栓形成、下肢血栓からの肺塞栓症による急死、心筋梗塞・心筋炎による急変なども相次いで報告されました1)。そののちにこの疾患は、川崎病とはやや病状が異なり、新たな疾患としてMultisystem Inflammatory Syndrome in Children ( MIS-C ; 小児多系統炎症性症候群 )と命名されました2)。川崎病とMIS-Cは、長引く発熱、皮膚の発疹、リンパ節腫脹、下痢、炎症性バイオマーカーの上昇など、いくつかの共通の症状を持っていますが、MIS-Cは10代と発症年齢が高いこと、腹部症状が多いこと、左室収縮機能障害や急性心不全を伴う症例が多いことなどの特徴があります3)。
MIS-Aについて私たちが知っていること
小児多系統炎症性症候群(MIS-C)は、COVID-19を引き起こすウイルスであるSARS-CoV-2に感染した小児および青年ではまれですが、重篤な状態です。2020年6月以降、成人における同様の多系統炎症性症候群(MIS-A)の報告がいくつかあります。CDC は、MIS-Aの説明に適合する多くの事例を公開しました。このレポートは、症候群が大人に現れる方法が子供よりも複雑である可能性があることを示しています。
SARS-CoV-2がスーパー抗原を含むかどうかの問題は確定していないが、証拠は蓄積されており [90,91,92,93,94,95] 、SARS-CoV-2はスーパー抗原またはスーパー抗原様の臨床症状やバイオマーカーを引き起こしている。サイトカインストーム[96]、T細胞の活性化と欠失[74]、MIS-Cの提示[73,97,98](超抗原曝露の結果として疑われている川崎病と同様[99])に加えて、感染後にロングCOVIDを発症するSARS-CoV-2感染者は、SLE[101,102,103]などの自己免疫疾患で典型的に見られる症状[100]を示し、自己抗体[71]と抗核抗体[72]はそうした個人の一部で検出されています[104]。
SARS-CoV-2のスーパー抗原様領域のin vitroでの評価は、in vivoでの免疫系に対する生理学的効果を完全に捉えていない可能性がある。例えば、リポポリサッカライド(LPS)は、SEBスーパー抗原効果を増強することができ [105]、LPSトランスロケーションを介して、腸の炎症や傷害後のT細胞に相乗効果を与える可能性がある [106,107]。
SARS-CoV-2は、腸管上皮細胞に感染することが知られている[108
SARS-CoV-2がエプスタインバーウイルス[114]、サイトメガロウイルス[115,116]、ヒト内在性レトロウイルス[107]などの潜伏ウイルスを再活性化させるという証拠が積み重なって、SARS-CoV-2が腸管上皮細胞に感染することが知られている。
いくつかの国は、医療制度が対応できるのであれば、高レベルの感染を容認するようである。このアプローチは、集団の防御的な免疫レベルが達成され、維持され、再感染による影響が少なくなると信じることが前提となっている[ ]。
スーパー抗原の毒性作用は、特異的な抗体によって阻害されうるという証拠があるが、付与される防御は、抗体価および曝露量に依存するようである[121]。ワクチン接種後のMIS-Cの減少という最近の証拠は、超抗原または超抗原様感染の臨床症状の予防における抗体の保護的役割を支持する[122]。しかし、SARS-CoV-2のワクチン接種[123]または感染[124]後に見られる抗体価の低下、およびウイルスの進行中の進化[125]という背景では、反復暴露の影響は予測できないかもしれない。
SARS-CoV-2の広範な伝播は、有益となるどころか、有害となる可能性があり、ナイーブT細胞の枯渇を特徴とするロングCOVID [126] に苦しむ人口の増加は、警告となるかもしれない。川崎病といくつかの自己免疫疾患が長期的な健康と長寿に悪影響を及ぼす可能性があることを考えると[127,128]、持続性のいくつかの証拠を示し、繰り返し感染させることができる、空気感染[129]する可能性のある超抗原性または超抗原様病原体の広域感染を認める国家戦略は見当違いであるかもしれません。
6. 結論
SARS-CoV-2が超抗原、超抗原様、または超抗原性宿主反応を引き起こすとすれば、超抗原の予測不可能な性質は、繰り返し暴露されたときに人々に何が起こるかの評価を特に難しくし、ウイルスの長期的影響に関する全体の不確実性を増大させる [130,131] 。SARS-CoV-2の超抗原性を確認または否定するために、また、広範囲の感染を可能にする政策をとる政府がとっている長期的なリスクをより理解するために、そして、病原体にさらされた結果に対してよりよく防御するために中和抗体を常に高いレベルに保つことが必要かを理解するために、緊急の研究が必要である。SARS-CoV-2がスーパー抗原であるか、スーパー抗原様であるか、スーパー抗原性宿主反応を引き起こすかを決定的にすることは、感染の短期および長期にわたる影響をより良く理解するために極めて重要である。SARS-CoV-2に想定されるスーパー抗原様形質の1つは、、他のSARSや流行コロナウイルスには見られないユニークなものであり [83]、SARS-CoV-2の長期的解析によると、この配列は高度に維持されていると思われることに注意すべきである。[132]
著者貢献度
A.H.とA.L.は同等に貢献した。すべての著者はこの原稿を読み、同意している。
資金提供
この研究は、外部からの資金援助を受けていません。
利益相反
著者は利益相反を宣言していない。
ーーーここまでーーー
過去記事もご覧ください