カルボン酸に関する正誤問題
今日は,カルボン酸に関する正誤問題です。
分子中にカルボキシ基(-COOH)をもつ化合物をカルボン酸(分子式:CnH2nO2)といい,
多くのカルボン酸の名前は,最初に発見された動植物の名前からつけられた慣用名で呼ばれます。
反応は,特に
① 酸としての反応(中和反応,弱酸の遊離反応)
② 酸水物の生成反応
③ エステル化反応
の3つをおさえましょう。
★次の正誤を判定せよ。
■問題① 酢酸もステアリン酸も水によく溶ける。
■問題② カルボン酸の沸点は,同程度の分子量のアルカンより低い。
■問題③ マレイン酸は,フマル酸より融点が低い。
■問題④ ギ酸は,炭酸水より弱い酸性を示す。
■問題⑤ 安息香酸は,水にわずかしか溶けないが,酸性の水溶液にはよく溶ける。
■問題⑥ 乳酸には,光学異性体がある。
■問題⑦ ギ酸を濃硫酸で脱水すると,二酸化炭素が発生する。
■問題⑧ ギ酸は,アセトアルデヒドの酸化により得られる。
■問題⑨ p-キシレンを酸化すると,フタル酸が生成する。
■問題⑩ エタノールと酢酸の混合物に,濃硫酸を加えて加熱すると酢酸エチルが生成する。
■問題⑪ サリチル酸に無水酢酸を加えると,サリチル酸メチルが生成する。
■問題⑫ セッケンを加水分解すると,高級脂肪酸とグリセリンが得られる。
■問題⑬ 酢酸に十酸化四リン(五酸化二リン)を加えて熱すると,脱水し,無水酢酸が生成する。
■問題⑭ テレフタル酸を加熱すると,分子内のカルボキシ基2個から水1分子がとれて酸無水物が生じる。
■問題⑮ ギ酸にアンモニア性硝酸銀水溶液を加えて加熱すると,銀が析出する。
■問題⑯ アジピン酸は,鎖状の一価のカルボン酸である。
★解答
□問題①
□解答 …… 誤り。
酢酸は,水によく溶けますが,ステアリン酸C17H35COOHは,ほとんど水に溶けません。
カルボン酸は,カルボキシ基(-COOH)が極性の大きい親水基のため,Cの少ない低級カルボン酸は水に溶けます。
しかし,ステアリン酸は高級脂肪酸で,長い炭化水素基(C17H35)が疎水基のため,分子全体に占める親水基の影響が小さくなるので水に溶けにくくなります。
酢酸は,刺激臭のある無色の液体で,純粋なものは冬に凝固するので氷酢酸と呼ばれます。
□問題②
□解答 …… 誤り。
カルボン酸の沸点は,同程度の分子量のアルカンより高くなります。これは分子中に極性の大きいカルボキシ基(-COOH)をもち,分子どうしで水素結合するためです。
Point! 一般的な沸点の高さ(同程度の分子量)
カルボン酸>アルコール>アルデヒド,ケトン,エステル,アミン>エーテル>アルカン
□問題③
□解答 …… 誤り。
分子式がともにC4H4O4であるマレイン酸とフマル酸は,不飽和の2価のカルボン酸でシス形のマレイン酸とトランス形のフマル酸は,幾何異性体の関係にあります。
融点は,フマル酸の方がはるかに高くなります。
理由は,フマル酸は分子間だけで水素結合をするのに対し,マレイン酸は,分子内でも水素結合もするので,その分,分子間の水素結合の数が減少するためです。
マレイン酸とフマル酸に関する問題は頻出なので,次の点もおさえてください。
水への溶解性は,マレイン酸は極性分子(非対称形)で水にはよく溶けますが,フマル酸(対称形)は無極性分子で,水にはあまり溶けません。
脱水反応では,マレイン酸は2個の-COOH基が互いに近くにあるため,加熱するだけで分子内脱水が起こり,無水マレイン酸になりますが,フマル酸は,-COOH基が反対側で離れているため加熱しても脱水されません。
水素の付加反応では,両方とも水素が付加するとコハク酸C2H4(COOH)2が生成します。
□問題④
□解答 …… 誤り。
カルボン酸はその名の通り,酸性の化合物で,酸性は炭酸H2CO3より強く,
塩酸HClや硫酸H2SO4よりは弱くなります。酸の強さは次のようになります。
Point! 酸の強さ
塩酸>硫酸>スルホン酸>カルボン酸>炭酸>フェノール類
ギ酸は,刺激臭のある無色の液体で,脂肪酸の中で最も酸性が強く有毒です。ギは蟻(アリ)と書き,アリから発見されたことからこの名がつきました。
□問題⑤
□解答 …… 誤り。
水素ではなく,二酸化炭素が発生します。
HCOOH + NaHCO3 → HCOONa + H2O + CO2
炭酸塩や炭酸水素塩の水溶液にカルボン酸を加えると,二酸化炭素が発生し溶解します。
これは,酸の強さは,ギ酸(カルボン酸)>炭酸なので,弱酸の塩(炭酸水素ナトリウム)に弱酸(炭酸)より強い酸(ギ酸)を加えることで,強い酸が塩(ギ酸ナトリウム)になり,弱酸(炭酸)が遊離するという反応が起こるためです。
Point! 弱酸の遊離反応
「弱酸の塩」+「強酸」→「強酸の塩」+「弱酸」
※強・弱は相対的な関係
□問題⑥
□解答 …… 正しい。
4種が異なる原子または原子団と結合している炭素原子を不斉炭素原子といい,不斉炭素原子をもてば,必ず光学異性体をもちます。乳酸は,不斉炭素原子で光学異性体が存在します。
□問題⑦
□解答 …… 誤り。
二酸化炭素ではなく,一酸化炭素が生成します。
HCOOH → CO + H2O
濃硫酸は脱水作用があり,有機化合物中からHとOを2:1の割合で奪います。
□問題⑧
□解答 …… 誤り。
ギ酸は,ホルムアルデヒドの酸化により得られます。
アセトアルデヒドの酸化により得られるのは酢酸です。
□問題⑨
□解答 …… 誤り。
テレフタル酸が生成します。フタル酸は,o-キシレンを酸化することで得られます。
ベンゼン環に直接結合した炭化水素基は,過マンガン酸カリウムで酸化されるとカルボキシ基(-COOH)になります。
□問題⑩
□解答 …… 正しい。
カルボン酸とアルコールを反応させると,分子間で水1分子がとれてエステルが生成します。
この反応をエステル化といいます。
□問題⑪
□解答 …… 誤り。
サリチル酸メチルではなく,アセチルサリチル酸が生成します。
この反応は,フェノール性ヒドロキシ基(-OH)のHがアセチル基(CH3CO-)と置換する反応で,アセチル化と呼ばれます。
サリチル酸メチルは,サリチル酸にメタノールを加えると,エステル化が起こり生成します。
アセチルサリチル酸は,白色の結晶で,解熱・鎮痛剤として,サリチル酸メチルは,油状の液体で,消炎・鎮痛剤(筋肉などに貼る湿布)などとして用いられます。
□問題⑫
□解答 …… 誤り。
セッケンではなく,油脂を加水分解すると,高級脂肪酸とグリセリンが得られます。
□問題⑬
□解答 …… 正しい。
反応式は次のようになり,無水酢酸が生成します。
2CH3COOH → (CH3CO)2O + H2O
カルボン酸2分子から水1分子がとれた形の化合物を酸無水物といい,酢酸から水1分子がとれた化合物を無水酢酸といいます。
無水酢酸を水とともに加熱すると,加水分解し,酢酸の水溶液となります。
アルコールから分子間脱水でエーテルをつくる場合は,「濃硫酸+加熱」でつくれましたが,カルボン酸は比較的安定なので,「濃硫酸+加熱」だけでは脱水されず,
「十酸化四リンのような脱水剤+加熱」を用いて作ります。
これによって得られた無水酢酸は,反応性が高いので,エステルやアミドを合成(アセチル化)する際に用いられます。
□問題⑭
□解答 …… 誤り。
テレフタル酸ではなくて,フタル酸を加熱すると,酸無水物が生成します。
テレフタル酸は,ベンゼン環に結合した2つのカルボキシ基が反対側にあるので,加熱しても脱水せず,酸無水物を生じません。

□問題⑮
□解答 …… 正しい。
一般に,カルボン酸は,酸化されにくいため,還元性をもちませんが,ギ酸はアルデヒド基をもつため還元性をもち,銀鏡反応を示します。
ただし,ギ酸はフェーリング反応は示さないので注意してください。
理由は,ギ酸イオンが銅イオンと安定なキレート錯体を形成し,銅イオンが酸化銅(I)として沈澱するのを妨げるからだと考えられます。
□問題⑯
□解答 …… 誤り。
アジピン酸は鎖状の二価のカルボン酸で,鎖状のジアミンであるヘキサメチレンジ
アミンと縮合重合反応をして,6,6ナイロンが生成します。
分子中にカルボキシ基(-COOH)をもつ化合物をカルボン酸(分子式:CnH2nO2)といい,
多くのカルボン酸の名前は,最初に発見された動植物の名前からつけられた慣用名で呼ばれます。
反応は,特に
① 酸としての反応(中和反応,弱酸の遊離反応)
② 酸水物の生成反応
③ エステル化反応
の3つをおさえましょう。
★次の正誤を判定せよ。
■問題① 酢酸もステアリン酸も水によく溶ける。
■問題② カルボン酸の沸点は,同程度の分子量のアルカンより低い。
■問題③ マレイン酸は,フマル酸より融点が低い。
■問題④ ギ酸は,炭酸水より弱い酸性を示す。
■問題⑤ 安息香酸は,水にわずかしか溶けないが,酸性の水溶液にはよく溶ける。
■問題⑥ 乳酸には,光学異性体がある。
■問題⑦ ギ酸を濃硫酸で脱水すると,二酸化炭素が発生する。
■問題⑧ ギ酸は,アセトアルデヒドの酸化により得られる。
■問題⑨ p-キシレンを酸化すると,フタル酸が生成する。
■問題⑩ エタノールと酢酸の混合物に,濃硫酸を加えて加熱すると酢酸エチルが生成する。
■問題⑪ サリチル酸に無水酢酸を加えると,サリチル酸メチルが生成する。
■問題⑫ セッケンを加水分解すると,高級脂肪酸とグリセリンが得られる。
■問題⑬ 酢酸に十酸化四リン(五酸化二リン)を加えて熱すると,脱水し,無水酢酸が生成する。
■問題⑭ テレフタル酸を加熱すると,分子内のカルボキシ基2個から水1分子がとれて酸無水物が生じる。
■問題⑮ ギ酸にアンモニア性硝酸銀水溶液を加えて加熱すると,銀が析出する。
■問題⑯ アジピン酸は,鎖状の一価のカルボン酸である。
★解答
□問題①
□解答 …… 誤り。
酢酸は,水によく溶けますが,ステアリン酸C17H35COOHは,ほとんど水に溶けません。
カルボン酸は,カルボキシ基(-COOH)が極性の大きい親水基のため,Cの少ない低級カルボン酸は水に溶けます。
しかし,ステアリン酸は高級脂肪酸で,長い炭化水素基(C17H35)が疎水基のため,分子全体に占める親水基の影響が小さくなるので水に溶けにくくなります。
酢酸は,刺激臭のある無色の液体で,純粋なものは冬に凝固するので氷酢酸と呼ばれます。
□問題②
□解答 …… 誤り。
カルボン酸の沸点は,同程度の分子量のアルカンより高くなります。これは分子中に極性の大きいカルボキシ基(-COOH)をもち,分子どうしで水素結合するためです。
Point! 一般的な沸点の高さ(同程度の分子量)
カルボン酸>アルコール>アルデヒド,ケトン,エステル,アミン>エーテル>アルカン
□問題③
□解答 …… 誤り。
分子式がともにC4H4O4であるマレイン酸とフマル酸は,不飽和の2価のカルボン酸でシス形のマレイン酸とトランス形のフマル酸は,幾何異性体の関係にあります。
融点は,フマル酸の方がはるかに高くなります。
理由は,フマル酸は分子間だけで水素結合をするのに対し,マレイン酸は,分子内でも水素結合もするので,その分,分子間の水素結合の数が減少するためです。
マレイン酸とフマル酸に関する問題は頻出なので,次の点もおさえてください。
水への溶解性は,マレイン酸は極性分子(非対称形)で水にはよく溶けますが,フマル酸(対称形)は無極性分子で,水にはあまり溶けません。
脱水反応では,マレイン酸は2個の-COOH基が互いに近くにあるため,加熱するだけで分子内脱水が起こり,無水マレイン酸になりますが,フマル酸は,-COOH基が反対側で離れているため加熱しても脱水されません。
水素の付加反応では,両方とも水素が付加するとコハク酸C2H4(COOH)2が生成します。
□問題④
□解答 …… 誤り。
カルボン酸はその名の通り,酸性の化合物で,酸性は炭酸H2CO3より強く,
塩酸HClや硫酸H2SO4よりは弱くなります。酸の強さは次のようになります。
Point! 酸の強さ
塩酸>硫酸>スルホン酸>カルボン酸>炭酸>フェノール類
ギ酸は,刺激臭のある無色の液体で,脂肪酸の中で最も酸性が強く有毒です。ギは蟻(アリ)と書き,アリから発見されたことからこの名がつきました。
□問題⑤
□解答 …… 誤り。
水素ではなく,二酸化炭素が発生します。
HCOOH + NaHCO3 → HCOONa + H2O + CO2
炭酸塩や炭酸水素塩の水溶液にカルボン酸を加えると,二酸化炭素が発生し溶解します。
これは,酸の強さは,ギ酸(カルボン酸)>炭酸なので,弱酸の塩(炭酸水素ナトリウム)に弱酸(炭酸)より強い酸(ギ酸)を加えることで,強い酸が塩(ギ酸ナトリウム)になり,弱酸(炭酸)が遊離するという反応が起こるためです。
Point! 弱酸の遊離反応
「弱酸の塩」+「強酸」→「強酸の塩」+「弱酸」
※強・弱は相対的な関係
□問題⑥
□解答 …… 正しい。
4種が異なる原子または原子団と結合している炭素原子を不斉炭素原子といい,不斉炭素原子をもてば,必ず光学異性体をもちます。乳酸は,不斉炭素原子で光学異性体が存在します。
□問題⑦
□解答 …… 誤り。
二酸化炭素ではなく,一酸化炭素が生成します。
HCOOH → CO + H2O
濃硫酸は脱水作用があり,有機化合物中からHとOを2:1の割合で奪います。
□問題⑧
□解答 …… 誤り。
ギ酸は,ホルムアルデヒドの酸化により得られます。
アセトアルデヒドの酸化により得られるのは酢酸です。
□問題⑨
□解答 …… 誤り。
テレフタル酸が生成します。フタル酸は,o-キシレンを酸化することで得られます。
ベンゼン環に直接結合した炭化水素基は,過マンガン酸カリウムで酸化されるとカルボキシ基(-COOH)になります。
□問題⑩
□解答 …… 正しい。
カルボン酸とアルコールを反応させると,分子間で水1分子がとれてエステルが生成します。
この反応をエステル化といいます。
□問題⑪
□解答 …… 誤り。
サリチル酸メチルではなく,アセチルサリチル酸が生成します。
この反応は,フェノール性ヒドロキシ基(-OH)のHがアセチル基(CH3CO-)と置換する反応で,アセチル化と呼ばれます。
サリチル酸メチルは,サリチル酸にメタノールを加えると,エステル化が起こり生成します。
アセチルサリチル酸は,白色の結晶で,解熱・鎮痛剤として,サリチル酸メチルは,油状の液体で,消炎・鎮痛剤(筋肉などに貼る湿布)などとして用いられます。
□問題⑫
□解答 …… 誤り。
セッケンではなく,油脂を加水分解すると,高級脂肪酸とグリセリンが得られます。
□問題⑬
□解答 …… 正しい。
反応式は次のようになり,無水酢酸が生成します。
2CH3COOH → (CH3CO)2O + H2O
カルボン酸2分子から水1分子がとれた形の化合物を酸無水物といい,酢酸から水1分子がとれた化合物を無水酢酸といいます。
無水酢酸を水とともに加熱すると,加水分解し,酢酸の水溶液となります。
アルコールから分子間脱水でエーテルをつくる場合は,「濃硫酸+加熱」でつくれましたが,カルボン酸は比較的安定なので,「濃硫酸+加熱」だけでは脱水されず,
「十酸化四リンのような脱水剤+加熱」を用いて作ります。
これによって得られた無水酢酸は,反応性が高いので,エステルやアミドを合成(アセチル化)する際に用いられます。
□問題⑭
□解答 …… 誤り。
テレフタル酸ではなくて,フタル酸を加熱すると,酸無水物が生成します。
テレフタル酸は,ベンゼン環に結合した2つのカルボキシ基が反対側にあるので,加熱しても脱水せず,酸無水物を生じません。

□問題⑮
□解答 …… 正しい。
一般に,カルボン酸は,酸化されにくいため,還元性をもちませんが,ギ酸はアルデヒド基をもつため還元性をもち,銀鏡反応を示します。
ただし,ギ酸はフェーリング反応は示さないので注意してください。
理由は,ギ酸イオンが銅イオンと安定なキレート錯体を形成し,銅イオンが酸化銅(I)として沈澱するのを妨げるからだと考えられます。
□問題⑯
□解答 …… 誤り。
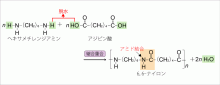
アジピン酸は鎖状の二価のカルボン酸で,鎖状のジアミンであるヘキサメチレンジ
アミンと縮合重合反応をして,6,6ナイロンが生成します。

アルデヒドに関する正誤問題
今日はアルデヒドに関する正誤問題です。
カルボニル基(-CO-)に2個の炭化水素基または水素原子が結合した構造をもつ化合物をカルボニル化合物といいます。
このうち,カルボニル基に水素原子が1個結合した化合物をアルデヒド(分子式:CnH2nO),2個の炭化水素基が結合した化合物をケトンといいます。
アルデヒドは,代表であるホルムアルデヒドとアセトアルデヒドの性質と反応についておさえることがポイントです。
★次の正誤を判定せよ。
■問題① ホルムアルデヒドやアセトアルデヒドは,水によく溶ける。
■問題② アセトアルデヒドの水溶液は,酸性である。
■問題③ アルデヒドの沸点は,同程度の分子量のアルコールと比べると低く,アルカンと比べると高い。
■問題④ アセトアルデヒドとアセトンは,互いに構造異性体の関係にある。
■問題⑤ エタノールに硫酸酸性の二クロム酸カリウム水溶液を加え,加熱するとホルムトアルデヒドが生成する。
■問題⑥ プロペンを触媒を用いて空気酸化すると,アセトアルデヒドが生成する。
■問題⑦ アセチレンに触媒を用いて水を付加させると,アセトアルデヒドになる。
■問題⑧ 2-ブテンをオゾン分解(酸化)すると,ホルムアルデヒドが生成する。
■問題⑨ ベンズアルデヒドを酸化すると,安息香酸が生成する。
■問題⑩ アセトアルデヒドにフェーリング液を加えて煮沸すると,酸化銅(Ⅰ)が青色沈殿する。
■問題⑪ アセトアルデヒドにアンモニア性硝酸銀水溶液を加えて加熱すると,銀が析出する。
■問題⑫ 合成樹脂であるフェノール樹脂,メラミン樹脂,ユリア樹脂のいずれもアセトアルデヒドが単量体の1つとなっている。
★解答
□問題①
□解答 …… 正しい。
アルデヒドは,カルボニル基-CO-をもつため,水の-OHと水素結合を形成するため,低級のアルデヒドは水によく溶けます。
ホルムアルデヒドは,無色・刺激臭の気体で,その30~40%の水溶液をホルマリンといいます。
ホルムアルデヒドは,消毒剤や防腐剤に用いる他,合成樹脂や合成繊維に用いられます。
アセトアルデヒドは,刺激臭の液体で,引火性があるので,取り扱いには注意が必要です。
□問題②
□解答 …… 誤り。
アルデヒドの水溶液は,分子中のC-H結合は極性が小さく,H+として電離しないので,中性を示します。
よって,酸・塩基とは中和反応しません。
□問題③
□解答 …… 正しい。
アルデヒドは,アルコールのようにヒドロキシ基-OHを持たないので,同分子間で水素結合は形成されないため,アルコールより沸点は低くなります。
しかし,カルボニル基(-CO-)には,極性があるため,無極性分子であるアルカンより沸点は高くなります。
Point! 一般的な沸点の高さ(同程度の分子量)
カルボン酸>アルコール>アルデヒド,ケトン,エステル,アミン>エーテル>アルカン
□問題④
□解答 …… 誤り。
アセトアルデヒドではなくて,プロピオンアルデヒドとアセトンは,ともに分子式がC3H6Oで,互いに構造異性体の関係にあります。
アルデヒドとケトンは,互いに構造異性体の関係にあり,アルデヒドはケトンと異なり,還元性を示す(酸化されやすい)性質より,両者を判別することができます。
□問題⑤
□解答 …… 誤り。
ホルムトアルデヒドではなく,アセトアルデヒドが生成します。
第一級アルコールを酸化すると,H2個が奪われてアルデヒドになります。
ホルムアルデヒドは,メタノールを酸化することで得られます。
□問題⑥
□解答 …… 誤り。
プロペンではなくて,エチレンを塩化パラジウム(Ⅱ)PdCl2と塩化銅(Ⅱ)CuCl2を触媒として,空気酸化すると,アセトアルデヒドが生成します。
この反応は,アセトアルデヒドの工業的製法で,ヘキストワッカー法といいましたね。
□問題⑦
□解答 …… 正しい。
アセチレンに触媒(硫酸水銀(Ⅱ))を用いて水を付加させると,ビニルアルコール(不安定)を経て,アセトアルデヒドになります。
□問題⑧
□解答 …… 誤り。
ホルムアルデヒドではなく,アセトアルデヒドが生成します。
Point! アセトアルデヒドの製法
① エタノールの酸化
② エチレンの酸化(ヘキストワッカー法)
③ アセチレンの水の付加
④ 2-ブテンのオゾン分解(酸化)
□問題⑨
□解答 …… 正しい。
側鎖のアルデヒド基-CHOは酸化によってカルボキシ基-COOHとなるため,安息香酸が生成します。
□問題⑩
□解答 …… 誤り。
フェーリング液は青色(Cu2+の色)ですが,酸化銅(Ⅰ)は赤色です。この反応をフェーリング反応といい,アルデヒドの検出反応として用いられます。
アルデヒドは,酸化されてカルボン酸になりやすい。つまり,酸化されやすいということは相手を還元する性質が強いということであり,フェーリング液を還元します。
□問題⑪
□解答 …… 正しい。
ジアンミン銀(Ⅰ)イオン[Ag(NH3)2]+の水溶液を,アンモニア性硝酸銀水溶液(トレンス試薬)といい,これにアルデヒドを加えて温めると,銀イオンAg+が還元されて,
単体のAgとなり,容器の内壁に付着して鏡のようになります。
この反応は,銀鏡反応といい,フェーリング反応同様にアルデヒドの検出反応として用いられます。
□問題⑫
□解答 …… 誤り。
アセトアルデヒドではなく,ホルムアルデヒドが単量体の1つとなっています。
カルボニル基(-CO-)に2個の炭化水素基または水素原子が結合した構造をもつ化合物をカルボニル化合物といいます。
このうち,カルボニル基に水素原子が1個結合した化合物をアルデヒド(分子式:CnH2nO),2個の炭化水素基が結合した化合物をケトンといいます。
アルデヒドは,代表であるホルムアルデヒドとアセトアルデヒドの性質と反応についておさえることがポイントです。
★次の正誤を判定せよ。
■問題① ホルムアルデヒドやアセトアルデヒドは,水によく溶ける。
■問題② アセトアルデヒドの水溶液は,酸性である。
■問題③ アルデヒドの沸点は,同程度の分子量のアルコールと比べると低く,アルカンと比べると高い。
■問題④ アセトアルデヒドとアセトンは,互いに構造異性体の関係にある。
■問題⑤ エタノールに硫酸酸性の二クロム酸カリウム水溶液を加え,加熱するとホルムトアルデヒドが生成する。
■問題⑥ プロペンを触媒を用いて空気酸化すると,アセトアルデヒドが生成する。
■問題⑦ アセチレンに触媒を用いて水を付加させると,アセトアルデヒドになる。
■問題⑧ 2-ブテンをオゾン分解(酸化)すると,ホルムアルデヒドが生成する。
■問題⑨ ベンズアルデヒドを酸化すると,安息香酸が生成する。
■問題⑩ アセトアルデヒドにフェーリング液を加えて煮沸すると,酸化銅(Ⅰ)が青色沈殿する。
■問題⑪ アセトアルデヒドにアンモニア性硝酸銀水溶液を加えて加熱すると,銀が析出する。
■問題⑫ 合成樹脂であるフェノール樹脂,メラミン樹脂,ユリア樹脂のいずれもアセトアルデヒドが単量体の1つとなっている。
★解答
□問題①
□解答 …… 正しい。
アルデヒドは,カルボニル基-CO-をもつため,水の-OHと水素結合を形成するため,低級のアルデヒドは水によく溶けます。
ホルムアルデヒドは,無色・刺激臭の気体で,その30~40%の水溶液をホルマリンといいます。
ホルムアルデヒドは,消毒剤や防腐剤に用いる他,合成樹脂や合成繊維に用いられます。
アセトアルデヒドは,刺激臭の液体で,引火性があるので,取り扱いには注意が必要です。
□問題②
□解答 …… 誤り。
アルデヒドの水溶液は,分子中のC-H結合は極性が小さく,H+として電離しないので,中性を示します。
よって,酸・塩基とは中和反応しません。
□問題③
□解答 …… 正しい。
アルデヒドは,アルコールのようにヒドロキシ基-OHを持たないので,同分子間で水素結合は形成されないため,アルコールより沸点は低くなります。
しかし,カルボニル基(-CO-)には,極性があるため,無極性分子であるアルカンより沸点は高くなります。
Point! 一般的な沸点の高さ(同程度の分子量)
カルボン酸>アルコール>アルデヒド,ケトン,エステル,アミン>エーテル>アルカン
□問題④
□解答 …… 誤り。
アセトアルデヒドではなくて,プロピオンアルデヒドとアセトンは,ともに分子式がC3H6Oで,互いに構造異性体の関係にあります。
アルデヒドとケトンは,互いに構造異性体の関係にあり,アルデヒドはケトンと異なり,還元性を示す(酸化されやすい)性質より,両者を判別することができます。
□問題⑤
□解答 …… 誤り。
ホルムトアルデヒドではなく,アセトアルデヒドが生成します。
第一級アルコールを酸化すると,H2個が奪われてアルデヒドになります。
ホルムアルデヒドは,メタノールを酸化することで得られます。
□問題⑥
□解答 …… 誤り。
プロペンではなくて,エチレンを塩化パラジウム(Ⅱ)PdCl2と塩化銅(Ⅱ)CuCl2を触媒として,空気酸化すると,アセトアルデヒドが生成します。
この反応は,アセトアルデヒドの工業的製法で,ヘキストワッカー法といいましたね。
□問題⑦
□解答 …… 正しい。
アセチレンに触媒(硫酸水銀(Ⅱ))を用いて水を付加させると,ビニルアルコール(不安定)を経て,アセトアルデヒドになります。
□問題⑧
□解答 …… 誤り。
ホルムアルデヒドではなく,アセトアルデヒドが生成します。
Point! アセトアルデヒドの製法
① エタノールの酸化
② エチレンの酸化(ヘキストワッカー法)
③ アセチレンの水の付加
④ 2-ブテンのオゾン分解(酸化)
□問題⑨
□解答 …… 正しい。
側鎖のアルデヒド基-CHOは酸化によってカルボキシ基-COOHとなるため,安息香酸が生成します。
□問題⑩
□解答 …… 誤り。
フェーリング液は青色(Cu2+の色)ですが,酸化銅(Ⅰ)は赤色です。この反応をフェーリング反応といい,アルデヒドの検出反応として用いられます。
アルデヒドは,酸化されてカルボン酸になりやすい。つまり,酸化されやすいということは相手を還元する性質が強いということであり,フェーリング液を還元します。
□問題⑪
□解答 …… 正しい。
ジアンミン銀(Ⅰ)イオン[Ag(NH3)2]+の水溶液を,アンモニア性硝酸銀水溶液(トレンス試薬)といい,これにアルデヒドを加えて温めると,銀イオンAg+が還元されて,
単体のAgとなり,容器の内壁に付着して鏡のようになります。
この反応は,銀鏡反応といい,フェーリング反応同様にアルデヒドの検出反応として用いられます。
□問題⑫
□解答 …… 誤り。
アセトアルデヒドではなく,ホルムアルデヒドが単量体の1つとなっています。
アルキンに関する正誤問題
今日はアルキンに関する正誤問題です。
分子内に1つの三重結合をもつ鎖式炭化水素をアルキンといい,一般式はCnnH2n-2で表されます。アルキンもアルケン同様に反応性に富むため,付加反応や付加重合反応を起こします。
アルキンに関する問題は,ほとんどがアセチレンで占められるので,アセチレンの性質・反応について,しっかりおさえましょう。
★次の正誤を判定せよ。
■問題① アセチレン分子は,直線形である。
■問題② アルキンの三重結合の結合距離は,アルケンの二重結合の結合距離より長い。
■問題③ アセチレンに火をつけると,明るい炎を出して燃える。
■問題④ アセチレンを空気中で点火すると,大量のススを出す。
■問題⑤ アルキンには,幾何異性体がある。
■問題⑥ 酢酸カルシウムに水を作用させると,アセチレンが生成する。
■問題⑦ アセチレンを赤熱した鉄管に通すと,ベンゼンが生成する。
■問題⑧ アセチレンに触媒を用いて水を付加させると,ビニルアルコールを経て酢酸になる。
■問題⑨ アセチレンに水素を付加させると,エタンからエチレンが生成する。
■問題⑩ アセチレンに酢酸を付加させると,酢酸エチルが生成する
■問題⑪ アセチレンに塩化水素を付加させると,エチレンが生成する。
■問題⑫ アセチレンをアンモニア性硝酸銀水溶液に通すと,銀アセチリドが白色沈殿する。
★解答
□問題①
□解答 …… 正しい。
三重結合している炭素原子に直接結合している2個の水素原子は一直線上に存在しているので,直線形となっています。
Point !
アセチレンや二酸化炭素は,直線構造。水は折れ線構造。
□問題②
□解答 …… 誤り。
三重結合の結合距離は,二重結合より短いです。
炭素間の結合の強さは,
三重結合>二重結合>ベンゼン環>単結合となり,
炭素間の結合距離は,
単結合>ベンゼン環>二重結合>三重結合となります。
C-C(1.54nm)>ベンゼン環(1.4nm)>C=C(1.34nm)>C≡C(1.20nm)
□問題③
□解答 …… 正しい。
アセチレンは酸素との混合気体の燃焼で.かなりの高温(約3000℃)となるため,金属の切断や溶接に利用されます。
□問題④
□解答 …… 正しい。
アセチレンは炭素の含有量が大きいので,空気中で点火すると,不完全燃焼を起こし,黒い大量のススをあげます。ベンゼンC6H6も炭素の含有量が大きいので,同様となります。
Point !
黒い大量のススとあったら,アセチレンかベンゼン!
□問題⑤
□解答 …… 誤り。
アルキンは二重結合をもたないため,幾何異性体はもちません。
幾何異性体をもつのは,アルケンです。
□問題⑥
□解答 …… 誤り。
酢酸カルシウムCH3COONaではなく炭化カルシウム(カーバイド)CaC2に水を作用させると,アセチレンが生成します。
無機物から有機物をつくる有名な反応です!
混同する人が多いので注意しましょう!
Point !
炭化カルシウムに水 → アセチレントン
酢酸カルシウムを乾留 → アセトン
□問題⑦
□解答 …… 正しい。
アセチレンを赤熱した鉄管に通すと,3分子が重合して,ベンゼンが生成します。
アセチレンからベンゼンが生成するので,アセチレンは芳香族化合物の出発点になり,さらに,付加反応でできた酢酸ビニルや塩化ビニルは付加重合をして合成高分子をつくるので,アセチレンは非常に重要な物質で入試でも超頻出です!
□問題⑧
□解答 …… 誤り。
酢酸ではなく,最終的にアセトアルデヒドが生成します。
水が付加すると,ビニルアルコールになりますが,ビニルアルコールは不安定のため,すぐにアセトアルデヒドに変わってしまいます。
アセトアルデヒドの製法の1つです。
かつては,アセトアルデヒドの主要な工業的製法でしたが,水銀公害問題から現在では使われていません。
問題には「硫酸水銀(Ⅱ)HgSO4を含む希硫酸中にアセチレンを通じる」と「水が付加する」とは書かれていないことがあるので,注意してください!
Point! アセトアルデヒドの製法
① エタノールの酸化
② エチレンの酸化(ヘキストワッカー法)
③ アセチレンの水の付加
④ 2-ブテンのオゾン分解(酸化)
□問題⑨
□解答 …… 誤り。
アセチレンにニッケルNiなどの触媒の下,水素を付加させると,エチレンを経て,エタンが生成します。
□問題⑩
□解答 …… 誤り。
酢酸エチルCH3COOC2H5ではなく,酢酸ビニルCH2=CHOCOCH3が生成します。
□問題⑪
□解答 …… 誤り。
エチレンではなく,塩化ビニルが生成します。
アセチレンは,三重結合C≡Cをもち,極めて反応性に富むため,付加反応をし,種々のビニル化合物が生成し,
さらに,これらの化合物が付加重合し,合成樹脂や合成繊維,合成ゴムなどの原料となります。
しかし,現在の化学工業では,塩化ビニルや酢酸ビニルは,エチレンを原料として
合成されています。
□問題⑫
□解答 …… 正しい。
アセチレンをアンモニア性硝酸銀水溶液に通すと,銀アセチリドが白色沈殿します。
三重結合をしている炭素原子に結合した水素原子は,水素イオンH+として離れ,Ag+やCu+などの金属イオンと置き換わります。
この置き換わった物質をアセチリドといい,この反応は-C≡C-Hのように末端に三重結合をもつアルキンの検出に用いられます。