抗体検査、IgMとIgGの違いって?
抗体検査とは過去にそのウイルスに感染していたかを調べる検査です。
抗体は免疫グロブリンというタンパク質のことであり、IgG、IgA、IgM、IgD、IgEの5種類があります。
今回はその中から主に検査の対象となるIgMとIgGの2種類の違いを説明いたします。
IgMとは
細菌に感染した時に一番最初に作られる抗体です。
発症してから1週目の中頃から後半に生成が開始され、検査で検出可能になるのは発症後2週目頃からとされています。
そのためウイルスに感染して間もないと陰性になってしまうことがあるため、現在感染していないという陰性の証明に利用することは難しいとされています。
その後、2週間から4週間ほどをかけて消失していき検査実施をしても検出されなくなります。
IgGとは
IgMが生成された後に生成され始めます。一般的に抗体検査というとこのIgGを調べることが多いです。
比較的長期間持続されるとされており、その期間は数ヶ月〜数年とウイルスによって異なります。(新型コロナウイルスの持続期間に関しては現在調査中です。)
IgGが消失すると再感染する恐れがあるため、ワクチンの接種などによって再度免疫を獲得することが望まれます。
このIgGの検査にはSタンパク質を標的としたもの、Nタンパク質を標的としたものがあり、コロナウイルスに感染した場合はSタンパク質とNタンパク質両方、mRNAワクチンで抗体を獲得した場合はSタンパク質のみが陽性になります。詳しくは以下の記事をご覧ください。
しかも、以下の論文で確認すると、どうやら日本人には交差免疫があったようですね。IgMが立ち上がる前にIgGが立ち上がるという事は、以前に感染した事があるという立派な証拠となります。ですから、最初は、そんなに感染者は出ませんでしたね。
感染経路は、喉と鼻ですからね。どうやって血中感染するんでしょうか?
1291種類もの副反応という病気があるわけですから、マッチポンプと言われていますね。
最初は身体の中からその役割を終えたら消えていくはずでしたが
しっかりと残っており体中を駆け巡り血管や内臓を傷つけまくる事が分かっています。
血栓が頭にできりゃなんですか?心臓にできりゃ?目の毛細血管にできりゃ?紅麹で話題の腎臓にできりゃ?www
もし何も知らないでぱかすか打ちだしたら、にっぽんこくじゅうれぷりこん音頭でしゃしゃんとね~と
なってしまいますので日本は終了します。
日本人集団におけるSARS-CoV2感染に対する
各クラスの抗体の反応速度:
IgAおよびIgG抗体価はIgM抗体価よりも早期に上昇した。
ハイライト
- -COVID-19における免疫を理解するためには、連続抗体測定が必要である。
- -IgAはIgMやIgGよりもすべてのウイルスタンパク質に対してより迅速に生成された。
- -S1タンパク質とRBDに対するIgG応答はより長い期間維持された。
- -IgGまたはIgAのセロコンバージョンがIgMのセロコンバージョンに先行することが多かった。
- -日本人集団には交差免疫が存在する可能性がある。
要旨
COVID-19感染者の重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染に対する免疫応答をよりよく理解するためには、COVID-19の臨床的特徴や感染拡大には欧米人とアジア人の集団でかなりの違いがあるようであるため、異なる集団における抗体応答の動態や臨床経過との関連を調べることが重要である。
本研究では,日本人のCOVID-19患者を対象に,SARS-CoV-2のヌクレオカプシド蛋白(NCP),スパイク蛋白(S1)サブユニット,S1サブユニットの受容体結合ドメイン(RBD)に対するIgM,IgG,IgA抗体の血清中力価を連続的に測定した.
IgM、IgG、IgA抗体のうち、前述のすべてのウイルス蛋白に対するIgA抗体が感染後最初に出現し、
IgGおよび/またはIgAのセロコンバージョンがIgMのセロコンバージョンに先行することが多かった。
異なるウイルス蛋白質(NCP、S1、RBD)に対する抗体応答の時期に関しては、
NCPに対するIgAはS1やRBDに対するIgAよりも早く出現し、
S1に対するIgMやIgGはNCPやRBDに対するIgM/IgGよりも早く出現した。
3種のウイルス蛋白質に対するIgG反応、S1およびRBDに対する3種の抗体クラスの反応は、
それぞれ3種のウイルス蛋白質に対するIgA/IgM反応、
NCPに対する3種の抗体クラスの反応よりも長い期間持続した。
NCPに対するIgAのセロコンバージョンは、軽症のCOVID-19患者では遅く、頻度も少なかった。
これらの結果は、SARS-CoV-2抗原に対する抗体応答が日本人と欧米人で異なる可能性を示唆している。
1. はじめに
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス感染症2019(COVID-19)は、2020年初頭に世界的大流行(パンデミック)と宣言され、この病気に関連した罹患率と死亡率は世界中で発生し続けている。コロナウイルスゲノムは4つの主要なタンパク質、すなわちスパイクタンパク質(S)、ヌクレオカプシドタンパク質(NCP)、エンベロープタンパク質、膜タンパク質をコードしている。スパイクタンパク質はS1とS2の2つのサブユニットからなり、S1サブユニットには受容体結合ドメイン(RBD)が含まれている[1],[2]。COVID-19患者におけるSARS-CoV-2に対する免疫応答をより明確に理解するためには、SARS-CoV-2感染に対する抗体応答の動態を調べることが重要である。SARS-CoV-2感染に対する抗体応答の動態を調べた研究は数多くあるが、同一患者における様々なSARS-CoV-2抗原に対するIgM、IgG、IgA応答の連続同時測定を行った研究はほとんどない[3],[4],[5],[6].
パンデミックの開始以来、COVID-19の臨床的特徴や感染拡大が人種間でかなり異なる可能性があることが明らかになった。欧米諸国の人々は、この病気が最初に確認された東アジアの人々よりも、ウイルスによる重症化しやすいようである[7] 。SARS-CoV-2に対する抗体反応の動態と関連性を、特に異なる集団における臨床経過と関連させて解析することで、このような民族的・人種的差異の理由を解明する手がかりが得られると考えられる。一般に感染症では、初感染時にはIgM反応がIgGやIgA反応に先行する。しかし、いくつかの研究では、SARS-CoV-2 IgGは、SARS-CoV-2 IgMよりも少し早く、あるいはCOVID-19の臨床経過中にほぼ同時に検出されることが多いと報告されている[3]、[8]、[9]、[10]、[11]、[12]、[13]、[14]。さらに、中国からのいくつかの報告では、IgGのセロコンバージョンがIgMのセロコンバージョンに先行していることが示されており[15]、[16]、異なる国の集団間で抗体反応のパターンが異なる可能性を示唆している。
異なる抗体クラスにおける血清転換の時期を比較し、SARS-CoV-2と他のコロナウイルスとの間の交差免疫の存在の可能性を検証するためには、特にCOVID-19の症状発現診断後の初期段階において、SARS-CoV-2の特異的抗原に対する抗体の頻繁かつ連続的な測定が必要である。日本人のCOVID-19患者の抗体反応動態を調べた研究はいくつかあるが、限られた時間内に限られた抗体型の反応しか測定しておらず、様々な抗体型の血清変換の時期の違いを正確に比較するには不十分である[6],[17],[18],[19],[20]。特に、日本人集団におけるRBDに対するIgA抗体やその他の抗体応答の時間経過を連続測定によって調べた研究はほとんどない。
このような状況下、本研究では、日本人集団に関連する以下の疑問に答えることを試みた。日本人SARS-CoV-2感染者において、異なるウイルス抗原に対する異なる抗体クラスの反応、特にセロコンバージョンの時期に違いはあるか?
2. 方法
2.1. 検体
RT-PCR法によりCOVID-19感染と診断された58名の血清検体を採取した。重症度グループ1(軽症;酸素療法を必要としない)、重症度グループ2(中等症;酸素療法を必要とするが、人工呼吸器は必要としない)、重症度グループ3(重症;人工呼吸器を必要とする)である。被験者の特徴はSupplemental Table S1に記載されている。
本研究はヘルシンキ宣言の倫理指針に従って行われた。参加者には研究についての説明を行い、インフォームド・コンセントはウェブサイト上のオプトアウトの形で得た。本研究に登録したくないと表明した患者は除外した。本研究デザインは、東京大学医科学研究センター倫理委員会の承認を得ており、保存検体を使用し、本レトロスペクティブ研究のデータは診療録(2019300NI-3および2019300NI-4)から検索したため、書面によるインフォームド・コンセントの取得の必要性は免除された。
2.2. SARS-CoV2に対する抗体の測定
抗体検査はiFlash3000全自動化学発光免疫測定装置(Shenzhen YHLO Biotech Co.) Qian Cら[21]により記述されたアッセイ手順を採用し、若干の修正を加えた。簡単に述べると、これらの化学発光 免疫測定キットの磁気ビーズに各主要SARS-CoV-2抗原(NCP、S1、RBD)をコートし、5μLの血清検体をビーズに加えた。その後、アクリジニウム標識抗ヒトIgM、IgGまたはIgA結合抗体を用いて、ビーズに結合した抗体を検出した。SARS-CoV-2 IgM、IgG、またはIgG抗体価は、iFlash光学系で検出されたRLUと、抗SARS-CoV-2 IgM、IgG、またはIgAキメラ抗体を含むキャリブレーターから計算されたカットオフ値を比較することにより、相対光単位(RLU)として計算され、1mlあたりの任意単位(AU/mL)で表記された。
2.3. 統計解析
COVID-19の症状発現後少なくとも45日まで抗体価をモニターした被験者の結果を用いて、症状発現後0日目から50日目(補足図S2)または0日目から210日目(図1)までの抗体価の変化の時間的経過を可視化するために、回帰分析に基づいてタイムポイントまたは散布図を滑らかな線で示す局所重み付け散布図平滑化(LOESS)をあてはめた。抗体反応の時間経過をさらに詳細に解析するために、2組の曲線を作成した。これらの曲線の説明に使用したサンプル数を補足表S2に示す。
図1. COVID-19患者における抗体の経時的反応曲線。COVID-19発症後少なくとも45日目まで抗体価をモニターした被験者(n = 35)の結果を用いて、COVID-19抗原に対する経時的な抗体反応を示す局所多項回帰曲線をフィッティングした。点線はカットオフレベルを示す。
すべてのデータはSPSS(Chicago, IL)を用いて統計的に分析した。結果はドットプロットで表し、バーは中央値を表す。ノンパラメトリック解析を行ったが、ほとんどのパラメータや解析でコルモゴロフ・スミルノフ検定やレーベン検定により正規性や分散の等質性が棄却されたためである。独立した3群間の抗体価は、独立したKruskal-Wallis検定と、それに続く事後分析のためのGames Howell検定を用いて比較し、対になった3群の抗体価、最大抗体価に調整した抗体価、ピーク抗体価の日数、診断からセロコンバージョンまでの間隔の日数は、Friedman順位検定と、それに続く事後分析のためのBonferroni検定を用いて比較した。異なる抗体クラスがウイルス抗原特異的な挙動を示すかどうかを視覚的に理解するために、各時点におけるすべての対の組み合わせとウイルス抗原の抗体価を比較した(図3および補足図S3)。正規分布を示さない個体については、Wilcoxon 符号順位検定 [22]を用いて抗体データのペア間の差異を同定した。多重比較の偽発見率を下げるために、Benjamini and Hochberg法[23]を採用した。すべての解析において、P<0.05を統計的有意性とみなした。
3. 結果
3.1. 3種のウイルス蛋白質に対するIgG反応、およびS1とRBDに対する3種の抗体クラスの反応は、比較的長期間持続した。
COVID-19患者58名の残存検体について、NCP(IgM(NCP)、IgG(NCP)、IgA(NCP))、S1(IgM(S1)、IgG(S1)、IgA(S1))、RBD(IgM(RBD)、IgG(RBD)、IgA(RBD))に対するIgM、IgG、IgAの血清中力価を測定した。陽性反応のカットオフ力価は、PCR陰性およびPCR陽性のCOVID-19患者から採取した血清中の抗体力価から適切と判断し、製剤担当者が決定した3つの抗体クラスすべてについて10 AU/mLとした(補足図S1)。
COVID-19の症状発現から少なくとも45日後まで抗体価をモニターした被験者の結果から描かれた0〜210日(図1)および0〜50日(補足図S2)の近似曲線を示す。IgG(S1)抗体価およびIgG(RBD)抗体価の上昇は6ヵ月以上持続し、IgA(S1)抗体価およびIgA(RBD)抗体価の上昇がそれに続いた。
3.2. IgA反応はIgMおよびIgG反応よりも早期に認められた
次に、SARS-CoV-2の各主要蛋白(NCP、S1、RBD)に対する各クラスの抗体の反応速度の違いを調べた(図2A、図3)。NCPに対する抗体反応では、34日目まではIgAとIgGの力価がIgMの力価よりも急速に上昇し、後期にはIgGの力価がIgAとIgMの力価よりも高くなった。S1蛋白およびRBDに対する抗体反応では、10日目まではIgA力価がIgM力価およびIgG力価よりも急速に上昇したが、その後はIgG力価が最も高く、次いでIgA力価、IgM力価の順であった。
図2. 3つの抗体クラスと3つのウイルス抗原に対する抗体価の順位。全対象者(n = 58)において、各ウイルスタンパク質に対して生成された抗体クラスの力価(A)と、3つのウイルスタンパク質に対して生成された抗体クラスの力価(B)を、フリードマン順位検定、および事後解析のためのボンフェローニ検定を用いて比較した。データは3つの抗体クラスの平均力価である。(A, B) *P < 0.05, **P < 0.01, ***P < 0.001, (A)† P < 0.05 IgM vs. IgG, ‡ P < 0.05 IgM vs. IgA, §P < 0.05 IgG vs. IgA, (B)† P < 0.05 N vs. S1, ‡ P < 0.05 N vs. RBD, §P < 0.05 S1 vs. RBD。
図3. COVID-19発症後日数別の抗体価。全対象者(n = 58)において、NCPとS1に対して生成された各抗体の力価を、Benjamini-Hochberg法による多重検定補正を行ったWilcoxon matched-pairs signed rank testを用いて比較した。p < 0.05、***p < 0.01、***p < 0.001。
3.3. S1に対するIgMとIgGの反応は早く起こり、NCPに対するIgAの反応は早く起こった。
3種類のウイルスタンパク質に対する各クラスの抗体の反応を比較したところ、反応速度に違いがあることも明らかになった(図2Bおよび補足図S3)。IgMの場合、13日目まではIgM(S1)の力価の上昇が早く、次いでIgM(RBD)、IgM(NCP)と続いたが、その後はIgM(S1)の力価はIgM(RBD)の力価とほとんど変わらなかった。IgGの場合、ほぼ全経過を通じてIgG(S1)力価が最も高く、次いでIgG(RBD)力価、IgG(NCP)力価であった。IgAについては、19日目まではIgA(NCP)力価が高いままであり、45日目からはIgA(NCP)力価はIgA(S1)力価およびIgA(RBD)力価よりも低くなる傾向にあった。
抗体キットによる抗体クラスや特定の抗原に対する抗体の検出能の違いによる交絡の影響を排除するために、少なくとも診断後45日目まで抗体価をモニターし、測定されたすべての抗体の最大抗体価がカットオフレベルを超えている被験者の最大抗体価に調整した抗体価の時間経過も解析した。補足図S4に示すように、IgG抗体価の上昇はよく持続し、次いでIgA抗体価およびIgM抗体価の上昇が続き、S1およびRBDに対する抗体価の上昇はNCPに対する抗体価よりも長期間持続した。代表的な被験者の抗体反応の時間経過を図4に示す。
図4. 代表的なCOVID-19被験者における抗体反応の時間経過。軽症COVID-19(A、B)、中等症COVID-19(C、D)、重症COVID-19(E、F)各2例における抗体反応の時間経過を示す。点線はカットオフ力価を表している。
3.4. 異なるウイルスタンパク質に対する抗体の最大力価は抗体クラス間で異なっていた。
次に、3つのウイルス蛋白に対する抗体クラス別の最大力価および診断からピーク力価までの間隔を比較した。NCPに対する抗体反応では、IgAおよびIgGの最大力価はIgMの最大力価よりも高く、IgG(NCP)のピーク力価はIgA(NCP)およびIgM(NCP)のピーク力価よりも遅れて到達した(図5A)。S1およびRBDに対する抗体応答については、IgG(S1, RBD)力価の最大値はIgM(S1, RBD)力価やIgA(S1, RBD)力価よりも高く、IgG(S1, RBD)力価はIgA(S1, RBD)力価やIgM(S1, RBD)力価よりも遅れてピークに達した(図5A)。抗体クラス間でピーク力価を比較すると、IgM(S1)とIgM(RBD)のピーク力価はIgM(NCP)のピーク力価よりも高く、IgGの最大力価に達した順番は、IgG(S1)、IgG(RBD)、IgG(NCP)の順であった(図5B)。IgAの場合、最大IgA(NCP)力価は最大IgA(S1)力価およびIgA(NCP)力価よりも高く、IgA(NCP)力価はIgA(S1)力価よりも早くピークに達した(図5B)。これらの結果は、特にNCPに対する抗体とS1またはRBDに対する抗体との間、およびIgAとIgMまたはIgGとの間で、最大抗体価および抗体価がピークに達した時点が異なることを示唆している。
以下略
https://www.sciencedirect.com/science/article/pii/S1567576921011279
そして↓
日本人の多くは風邪を記憶した免疫細胞が新型コロナも攻撃、「ファクターX」の可能性 理研が発見
2022.01.04
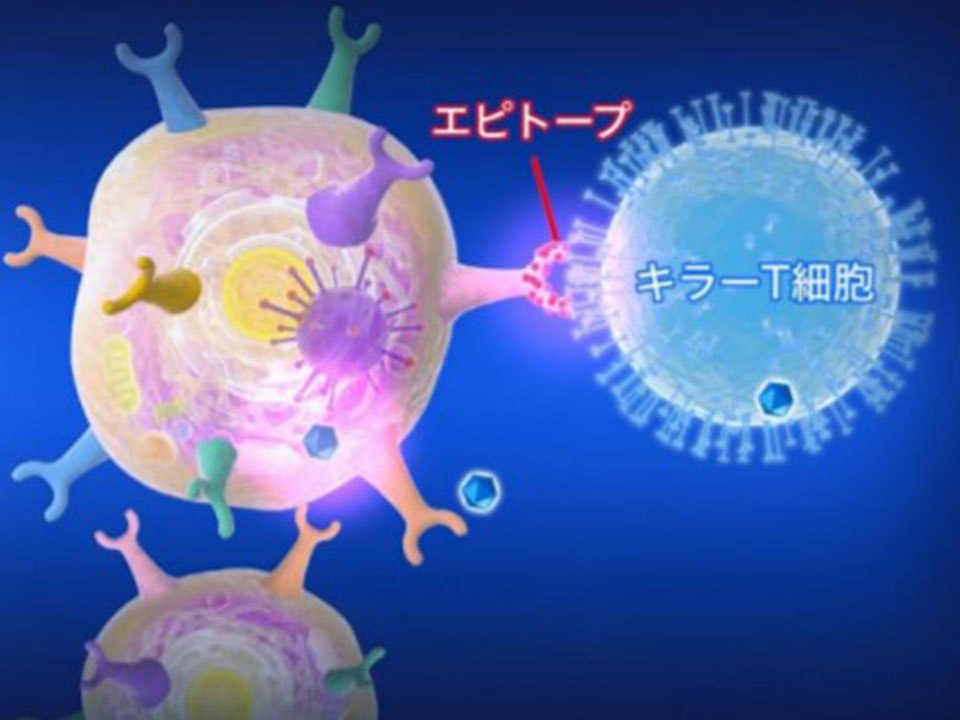
日本人に多い特定の白血球の型を持つ人は、風邪の原因となる従来型のコロナウイルスを記憶した免疫細胞が新型コロナウイルスの感染細胞も認識して攻撃することが分かった。免疫細胞の1つ「キラーT細胞」が2つのコロナウイルスに共通する分子「エピトープ」に反応することを理化学研究所の研究グループが突き止めた成果だ。新しいタイプの治療薬開発につながる可能性もあるという。
日本の新型コロナの感染者数が欧米と比べて少ないのは
日本人特有の要因「ファクターX」があるのではないかと
指摘されている。
研究グループはこの特定の白血球型「HLA-A24」が
ファクターXの1つである可能性もあるとしている。日本国内でも感染力が強いとされるオミクロン株の感染例が増えている。今年のコロナ禍がどうなるかは予断を許さないが、理研の研究成果のように日本人向けの治療薬やワクチンの開発につながる研究も望まれている。
免疫に重要な働きをする多型に富むHLA
私たちに馴染み深い血液型は通常「ABO式血液型」を指す。これは赤血球の型だ。免疫細胞である白血球にも型がある。それが「ヒト白血球型抗原」つまりHLAで、多型に富んでいる。HLAは白血球の型と称されることが多い。これは白血球の型として発見されたためだが、その後の研究で体のほとんどの細胞表面から発現し、細胞性免疫を誘導する重要な役割を担うことが分かっている。骨髄移植はドナーとレシピエントのHLAが一致することが条件で、「骨髄バンク」はさまざまなHLA型の人が登録している。
免疫学が専門の宮坂昌之・大阪大学名誉教授の説明によると、人間の体は自然免疫と獲得免疫という2段構えの防御システムを持っている。ウイルスや細菌などの病原体が体内に侵入すると、白血球の1つである食細胞が攻撃する。これが自然免疫だ。病原体がここを突破すると、やはり白血球の免疫細胞であるB細胞やT細胞が主体となって病原体と戦う。HLAは自然、獲得2つの免疫に重要な働きをする。
獲得免疫のうちB細胞は抗体を作ってウイルスと戦う。「疑似ワクチン」と言えるワクチンはこの抗体を人工的に作る。一方、T細胞の1つであるヘルパーT細胞は獲得免疫の司令塔で、ヘルパーT細胞がキラーT細胞に指令を出すとキラーT細胞が感染細胞を殺す。T細胞は獲得免疫の中核を担うが、敵対したウイルスを記憶する能力があるのが特長だ。これらの仕組みは細胞性免疫とも呼ばれる。
細胞がウイルスに感染すると、ウイルスの一部の分子が感染細胞の表面に出てくる。これがエピトープだ。一方、キラーT細胞の表面には異物、つまり敵を認識する分子であるT細胞受容体(TCR)が存在する。TCRが異物を認識するための標的となるのがエピトープなのだ。キラーT細胞はエピトープと結合してウイルスごと感染細胞を破壊する。
理研生命医科学研究センター免疫細胞治療研究チームの清水佳奈子上級研究員、藤井眞一郎チームリーダーらの共同研究グループは、このエピトープに着目してHLAの型との関係を調べた。HLA分子は体中のあらゆる細胞の表面に存在している。キラーT細胞が感染細胞を認識するためにはエピトープがHLA分子と結合しなければならない。エピトープは6~10個のアミノ酸や5~8個の単糖の配列で構成する。
キラーT細胞の標的は季節性、新型の両ウイルスに存在
研究グループによると、HLA分子は数万種類あり、個人個人は複数の型を持っている。HLA型は親から子へ遺伝する。このためHLA型の分布は人種によって異なる特徴が生じる。日本人に多いHLA型としてHLA-A24が知られる。日本人の約6割が持っているが、欧米人では1~2割程度しか持っていないと言われている。
藤井チームリーダーらは、新型コロナウイルス表面のスパイクタンパク質を調べた。その結果、HLA-A24と結合してキラーT細胞を活性化するエピトープを見つけた。さらにこのエピトープの類似部位が同じコロナウイルス仲間で風邪の原因となり、4種類ある従来型の季節性コロナウイルスにも存在すること、さらにこのエピトープはHLA-A24に結合してキラーT細胞を活性化することを突き止めた。
多くの人は季節性コロナウイルスの感染経験がある。このために体内にはこの感染を記憶している「記憶免疫キラーT細胞」が存在している。しかし、そのT細胞が新型コロナウイルスやその変異株に対する殺傷効果、つまり「交差免疫」を示すかどうかはこれまで検証できなかった。季節性コロナウイルスのエピトープは候補が多かったことや、キラーT細胞を増殖させることが難しいなど技術的課題があったためという。
藤井チームリーダーによると、今回、HLA-A24分子の関与により、季節性と新型の両方のコロナウイルスに交差免疫が働くことがはっきりした。また、交差免疫の鍵を握るエピトープを特定。特定したエピトープのペプチド(アミノ酸の鎖)は季節性、新型を問わずHLA-A24の分子と反応することを確認できたという。
研究グループには国立病院機構熊本医療センターも加わっており、成果は昨年12月に英科学誌「コミュニケーションズ・バイオロジー」電子版に掲載された。
新たなワクチンや治療薬開発につながると期待
日本人の新型コロナウイルス感染者数や死亡者数の割合は欧米に比べて低いことが知られているが、その明確な理由は分かっていない。これまでもその理由は何らかの形でHLAと関係があるのではないかという「HLA仮説」はあった。しかし具体的な研究成果はなく、仮説の域を出ていなかった。
HLAの1つの型であるHLA-A24は欧米人には少なく、日本人に多い。今回の研究成果は、HLA-A24を持つ日本人は過去の季節性コロナウイルス感染の記憶を持つキラーT細胞が速やかに活性化するため、新型コロナの発症や重症化を防いだ可能性を示している。藤井チームリーダーらはHLA-A24が「ファクターX」と断定はしてないものの、一要因である可能性は高いとの見方を示している。
新型コロナウイルス感染症予防対策の柱はワクチン接種だ。しかし様々な理由でワクチンを打てない人やワクチンを打っても抗体価がすぐに下がる人もいる。抗体だけを「武器」にはできない。ブレークスルー感染や新たな変異株に対抗するためにも細胞性免疫活用への期待は大きい。
今回の研究で見つかったエピトープで記憶免疫キラーT細胞を刺激すると、この免疫細胞は活性化し増殖したという。免疫反応を強く引き起こすエピトープが見つかったのだ。今後の研究の進展によっては新たな発想によるワクチン開発や、抗体に頼らない新しいタイプの治療薬の開発につながると期待されている。