転写因子とは
肝細胞へのダイレクトリプログラミングを誘導する分子メカニズムの解明―転写因子の新規作用機序の発見―
九州大学
日本医療研究開発機構
九州大学生体防御医学研究所の鈴木淳史教授、堀澤健一助教らの研究グループは、同研究所の大川恭行教授、京都大学の長﨑正朗教授、国立国際医療研究センターの植野和子研究員との共同研究により、線維芽細胞から肝細胞への直接的な運命転換(ダイレクトリプログラミング)を制御する分子メカニズムの解明に成功しました。
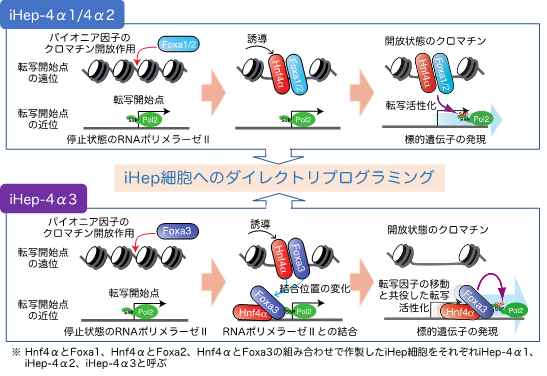
鈴木教授らは、2011年にマウスの皮膚から抽出した線維芽細胞に2つの転写因子※1(Hnf4αとFoxa1、2、3のいずれか1つ)を導入することで、線維芽細胞を肝細胞の性質を有する「iHep細胞」へと変化させることに成功しました(Sekiya and Suzuki, Nature, 2011)。本研究では、iHep細胞誘導因子である2つの転写因子の挙動を詳しく解析するとともに、線維芽細胞が肝細胞の運命を獲得する過程で生じる遺伝子発現変化やクロマチン※2状態変化、エピゲノム状態変化などを統合的に解析し、転写因子のDNAへの結合から始まる一連のダイナミックな細胞状態変化の全容を解明することができました。興味深いことに、iHep細胞誘導因子の1つであるFoxa3が、同じファミリーに属するFoxa1やFoxa2とは異なる様式で標的遺伝子の発現を誘導することが判明しました。本研究において、Foxa3がFoxa1やFoxa2と同じパイオニア因子※3としてクロマチン構造を開くことが明らかになりましたが、Foxa3はその後速やかに転写開始点付近に転位してRNAポリメラーゼⅡ※4と結合し、一緒にDNA上を動くことで標的遺伝子の転写を活性化することがわかりました。この特徴的なFoxa3の作用機序は、Hnf4αとFoxa3を用いたiHep細胞誘導に必要不可欠であることも判明しました。RNAポリメラーゼⅡと転写因子の機能的な結合はFoxa3以外の転写因子でも起こりうることから、細胞運命制御に関連する他の転写因子にも同様の働きが今後明らかになるかもしれません。本研究で明らかとなったiHep細胞の誘導メカニズムは、iHep細胞の質の向上や安全性の担保など、iHep細胞の医療応用において重要な知見になるだけでなく、肝細胞の分化機序やその破綻による病気の発症機構の解明にもつながると考えられます。
本研究成果は、2020年8月5日(水)午前0時(日本時間)に米国科学雑誌『Molecular Cell』 オンライン版に掲載される予定です。
用語の解説
- ※1転写因子
- DNAに結合して遺伝子の発現を調節するタンパク質であり、標的遺伝子に応じて多様な種類、組み合わせがある。
- ※2クロマチン
- 真核生物の核内に存在するDNAとタンパク質の複合体であり、ヒストン8量体にDNAが巻き付いたヌクレオソームを基本構造としてもつ。
- ※3パイオニア因子
- 高度に密集したクロマチン構造に結合してそれを弛緩させ、抑制されていた遺伝子発現を活性化する状態を作りうる特殊な転写因子のことを指す。
- ※4 RNAポリメラーゼⅡ
- 多数のサブユニットからなるタンパク質複合体を形成し、真核生物の核内でメッセンジャーRNAの転写を担う。
論文情報
- 雑誌名:
- Molecular Cell, 2020.
- 論文名:
- The dynamics of transcriptional activation by hepatic reprogramming factors
- 著者名:
- Horisawa K., *Udono M., *Ueno K., Ohkawa Y., Nagasaki M., Sekiya S., Suzuki A.
(* Co-second author)
研究助成金情報
本研究は、日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)」(2019年度~2021年度)、同「革新的先端研究開発支援事業(AMED-CREST)(エピゲノム研究に基づく診断・治療へ向けた新技術の創出)」(2011年度~2016年度)、同「肝炎等克服実用化研究事業」(2015年度~2017年度)、同「難治性疾患実用化研究事業」(2017年度~2019年度)、日本学術振興会「科学研究費助成事業(JP16H01850、JP16K08592、JP18H05102、JP19H01177、JP19H05267、JP20H05040)」、九州大学生体防御医学研究所共同利用・共同研究拠点「多階層生体防御システム研究拠点」などの支援を受けました。
お問い合わせ先
研究内容に関すること
鈴木 淳史(すずき あつし)
九州大学 生体防御医学研究所 器官発生再生学分野 教授
TEL:092-642-6449 FAX:092-642-6444
E-mail:suzukicks”AT”bioreg.kyushu-u.ac.jp
報道に関すること
九州大学 広報室
E-mail:koho”AT”jimu.kyushu-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部
再生医療研究開発課
TEL:03-6870-2220
E-mail:saisei”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月5日
最終更新日 令和2年8月5日
以下は「カズレーザーと学ぶ。」番組公式サイトです。
https://www.ntv.co.jp/kazu/articles/3115azh8d1ijlnu74qlo.html















