イオン化傾向と電極電位 こちらへ、、、
前回、金属は電子を放出する性質を持つ元素であることを説明しました。この金属が電子を放出する性質の大きさをイオン化傾向といいます。
イオン化列とイオン化傾向
イオン化傾向の大きなものほど電子を放出して陽イオンになりやすく ( 酸化されやすく ) 反応性の高い金属です。金属をこのイオン化傾向の大きな順に並べたものをイオン化列といい、下表のようになっています。

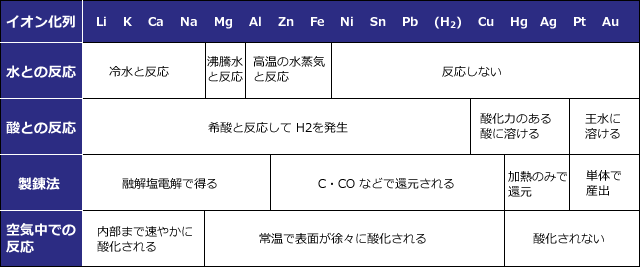
上表は空気や水や酸と各金属の反応ですが、イオン化傾向の大きなものほど激しく反応する事が分かりますね。
例えば、イオン化傾向の大きな Li~Na では空気中の酸素によって内部まで酸化されてしまうのに対して、イオン化傾向の小さな Pt や Au は空気によって全く酸化されません。
この2つめの表は大事ですから、このまま覚えてください。Al よりイオン化傾向の大きなものは融解塩電解で単体を得るという事や水・酸との反応は頻出です。
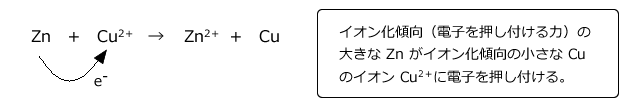
また、この表は、金属の単体が電子を放出する力の大きさの順を表しています。異なる2 種類の金属を接触させると、表面で電子の押し付け合いが起こり、イオン化傾向の大きい方から小さい方へと電子が流れます。(詳しくは次回、電池の原理を説明するときにお話しします。)
では、イオン化傾向の小さな金属のイオンと、イオン化傾向の大きな金属の単体を接触させたらどうなるでしょうか。
たとえば、硫酸銅水溶液中に、亜鉛の単体を入れると、Zn の方が Cu より電子を押し付ける力が強いため、次のような反応が起こって Zn が溶解して Zn 板の表面に Cu が析出します。
このとき、Cu が小さな枝のように Zn の表面に析出するため、銅樹と呼ばれます。同様の現象は、水溶液が硝酸銀の場合でも起こり、この場合は銀が析出するので、銀樹と呼びます。
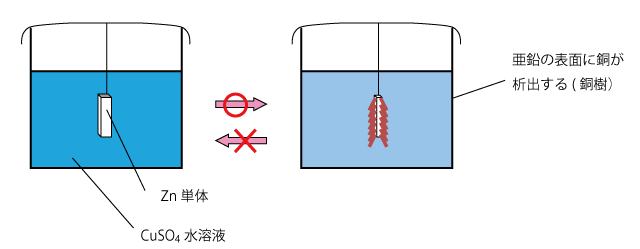
このとき、Cu が小さな枝のように Zn の表面に析出するため、銅樹と呼ばれます。同様の現象は、水溶液が硝酸銀の場合でも起こり、この場合は銀が析出するので、銀樹と呼びます。
酸化力のある酸に溶けない金属

酸と金属の反応について、もう少し突っ込んでおきましょう。
まず、金属が希酸に解けるのは、H+ と金属の酸化還元反応が起こるためです。例えば、HCl と Zn の反応では、以下のような半反応式で表される反応が起こります。
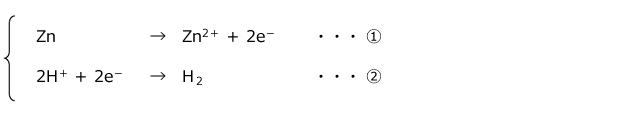
この2つをあわせると、亜鉛が希酸に溶ける反応式 Zn + 2H+ → Zn2+ + H2↑となります
これは、還元剤としての Zn の力(電子を押し付ける力)が、還元剤としての H2の力より強いために起こる反応です。ですから、H2よりイオン化傾向の小さな Cu~Au は希酸には溶けません。
Cu~Au はH+よりもっと酸化力のある酸に溶けます。酸化力のある酸というのは、熱濃硫酸・濃硝酸・希硝酸・王水の4つです。これらは強い酸化剤として働きますから、H2 よりイオン化傾向の小さな金属も酸化して陽イオンにしてしまいます。
ただし、イオン化傾向がものすごく小さな Pt と Au はこの中でも最も酸化力の強い王水にしか溶けません。王水は濃硝酸と濃塩酸を 1:3 の割合で混合したものです。(一生三円と覚えます。)
銅や銀が希硝酸・濃硝酸・熱濃硫酸に溶けるときの反応は頻出ですから、必ず書けるようにしましょう。
これは酸化還元反応なので、半反応式とイオン反応式を書いて考えます。
例として、銅と希硝酸の反応式書いてみます。手順は、酸化還元反応で説明した通りですね。
- 半反応式
-
Cu → Cu2+ + 2e- ・・・・ ① HNO3 + 3H+ + 3e- → NO + 2H2O ・・・・ ②
- イオン反応式(①×3+②×2)
-
3Cu + 2HNO3 + 6H+ → 3Cu2+ + 2NO + 4H2O
- 全反応式(左辺・右辺にそれぞれ 6NO3- を加える。)
-
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
このように、酸化力のある酸に金属が溶けたときに発生する気体は、H2ではなく、それぞれの酸が酸化剤として働いたときに発生する気体です。
それぞれの酸に金属が溶けたときに発生する気体はすぐに答えられるようにしましょう。色や性質も大切です。
濃硫酸と金属 → SO2 : 刺激臭、無色、殺菌漂白作用
濃硝酸と金属 → NO2 : 刺激臭、赤褐色、有毒
希硝酸と金属 → NO : 無臭、無色、空気中で酸化されて NO2 になる。
さて、希酸に溶けない金属すら溶かしてしまう酸化力のある酸は、どんな金属でも溶かしてしまうような気がしますが、実は、希酸に溶けるのに酸化力のある酸には溶けない金属も存在します。
それは、Al、Fe、Ni の3 種類の金属です。これらの金属は酸化力のある酸(濃硫酸・濃硝酸)を加えると、表面にち密な酸化被膜が生じてしまい、それ以上反応しなくなってしまいます。
このように、表面の酸化被膜によって薬品に侵されにくくなった状態を不動態と言います。ただし、これらの金属も希硝酸や王水には溶けます。この3 つは良く出てくるので覚えましょう。
あ(Al)て(Fe)に(Ni)ならない不動態というゴロは聞いたことがありますよね。
また、Pb は硫酸と塩酸に溶けません。Pb は硫酸イオンと水に不溶の PbSO4 を、塩化物イオンとは同じく水に不溶の PbCl2を生じます。これらが Pb の表面を覆ってしまうと、内部が保護されてしまい、それ以上酸に溶けなくなってしまうのですね。考え方は不動態と同じです。
今回はここまでにしましょう。今回はイオン化傾向の説明でしたが、次回以降、電池の性質について解説します。
1. 電食とは
異種金属が接触した状態で、金属に水等の通電性の液体が触れると電気が流れます。
電気が貴金属から卑金属に対して流れることで、卑金属がイオン化して
腐食することを電食と呼んでいます。(例:ボルタ電池)
※イオン化とは、金属が水等の通電性の液体中で陽イオンになろうとする性質のことです。
陽イオンになりやすいほど酸化されやすく、腐食しやすくなります。
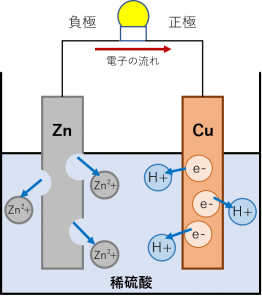
図:金属に含まれる物質のイオン化傾向
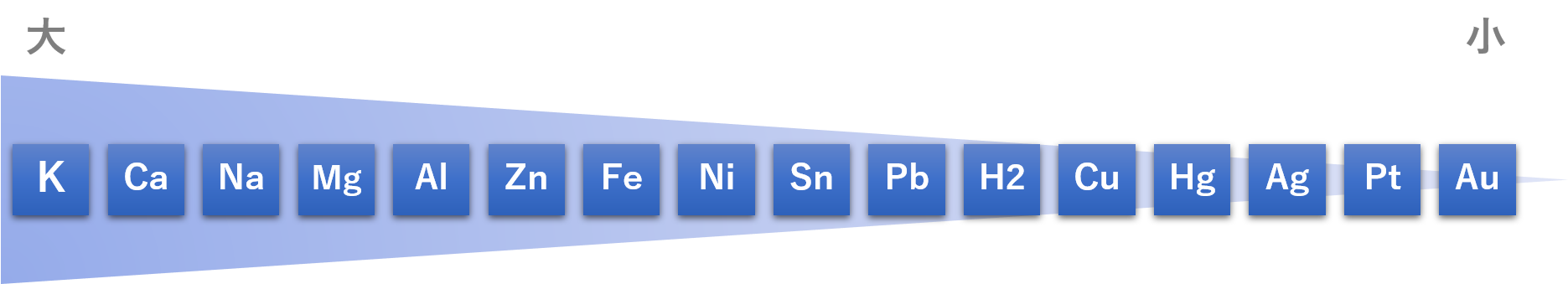
カリウム-カルシウム-ナトリウム-マグネシウム-アルミ-亜鉛-鉄-ニッケル-錫-鉛-<水素>-銅-水銀-銀-白金-金
※ステンレスは合金なので、イオン化列には入っていませんが、銅と同程度です。
2. 電食の発生しやすい条件
1⃣.金属の電位差が大きい
例えば、片方にステンレス、もう一方に亜鉛メッキをした鋼材を使用した場合、
単体では錆に強い材料同士ですが、電食に対しては弱い組み合わせになります。
※亜鉛メッキを先に腐食させて、中の金属を保護する目的で使用する場合もあるようです。
2⃣.水分の付着しやすい環境。
・湿度が高い環境
・屋外など雨や雪が直接付着する環境
・温度差が激しく結露しやすい環境
3. 電食を防止するには
1⃣.同種の金属を使用する
金属面が接触する必要がある場合、同種の金属を使用することで電食を防止できます。
また、電位差の少ない金属同士であれば、電食は起こりにくくなります。
2⃣.絶縁する
金属の接触面を塗装したり絶縁材料を挟み込んだりして絶縁することで、電食を防止できます。
3⃣.密閉する
金属面が接触する箇所を密閉することで、外部環境の影響を受けないようにします。
但し、密閉時に確実に乾燥させておかないと、結露などでも電食は発生します。
おまけ(JIS Z 0103-1996より)
JISの定義によると、電食とは厳密には迷走電流腐食のことを言い、正規の回路から外れて流れる電流によって起こる腐食のことを言います。
ここで説明している異種金属接触腐食のことはガルバニック腐食と言いますが、一纏めにして電食と呼んでいる人があまりにも多いので、電食と言った方が通じやすいです。
関連情報
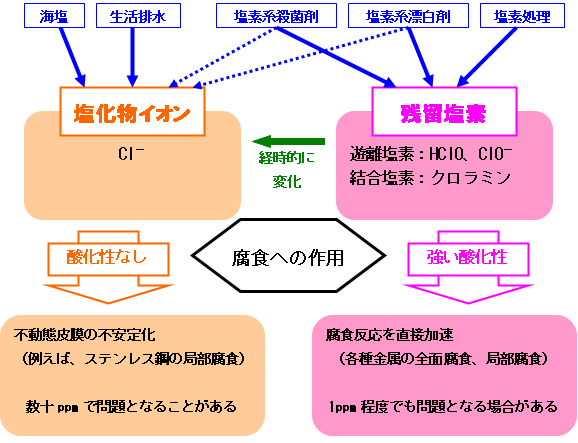
冷却水の水質分析項目中には、塩素に関連する項目として、「塩化物イオン」と「残留塩素」があります。
両方とも腐食を加速する作用がありますが、腐食加速のメカニズムと腐食が問題になる濃度が大きく異なります。
塩素に関連する項目を「塩素」などと一括りにし、両者が混同されている場合がありますが、「塩化物イオン」と「残留塩素」の違いを理解し、区別して管理することが重要です。
塩化物イオンとは、Cl-を指します。塩化物イオンは、海塩や生活排水、塩素系殺菌剤等から水中に混入します。
残留塩素は、遊離塩素と結合塩素をあわせたものです。遊離塩素は、HClO(次亜塩素酸)およびClO-(次亜塩素酸イオン)です。
遊離塩素は有効塩素とも呼ばれます。結合塩素は、遊離塩素がアンモニアと反応したクロラミン(例えば、NH2Cl)です。
アンモニアが少ない水の場合は、残留塩素は遊離塩素にほぼ等しくなります。残留塩素は、アンモニアの分解や殺菌処理、漂白処理のための塩素処理や次亜塩素酸ナトリウム添加により水中に存在します。
なお、残留塩素は、自然環境で安定性が小さく、経時的に塩化物イオンに変化します。
また、殺菌剤として添加される塩素系薬剤中には、残留塩素と塩化物イオンの両者が含まれますので、殺菌剤を添加することで残留塩素濃度とともに塩化物イオン濃度も増加します。
腐食は酸化反応ですので、環境の酸化性が腐食進行に大きく影響します。
塩化物イオンと残留塩素の腐食に対する作用の違いは、主に酸化性の有無に起因します。
塩化物イオンの塩素は-1価で酸化性を持ちません。
遊離塩素である次亜塩素酸および次亜塩素酸イオンの塩素は+1価で強力な酸化性を有しています。
酸化性が殺菌作用を発揮するため、遊離塩素は殺菌剤として利用されています。
水道水では、衛生上0.1ppm以上存在することが規定されています。
金属の腐食に対し、塩化物イオンは、金属の不動態皮膜を不安定にする作用があります。
特に、ステンレス鋼の局部腐食(すき間腐食や応力腐食割れ)の発生原因となります。材料の種類や塩化物イオン以外の環境要因(酸化性など)にもよりますが、中性水溶液の場合、おおよそ数十ppm以上で腐食が問題になる場合があります。
一方、残留塩素は、強い酸化性により金属の腐食を加速する作用があります。
例えば、炭素鋼の全面腐食を加速したり、ステンレス鋼の局部腐食を促進したりします。材料の種類や残留塩素以外の環境要因にもよりますが、1ppm程度の濃度で問題となる場合もあります。
付図 塩化物イオンと残留塩素の主な違い
溶存酸素
ヨウゾンサンソ 【英】Dissolved Oxygen [略]DO
水中に溶解している酸素の量のことで、代表的な水質汚濁状況を測る指標の1つ。
酸素の溶解度は水温、塩分、気圧等に影響され、水温の上昇につれて小さくなる。
酸素の溶解度が小さくなると同時に、光合成の原料となる二酸化炭素の溶解度も低下して光合成速度が落ちるため、水中の溶存酸素濃度は低下する。一方で、水温の上昇によって生物の活動は活発化し、呼吸や有機物の好気的分解による酸素消費速度量が増加する。
一般に清浄な河川ではほぼ飽和値に達しているが、水質汚濁が進んで水中の有機物が増えると、好気的微生物のよる有機物の分解に伴って多量の酸素が消費され、水中の溶存酸素濃度が低下する。溶存酸素の低下は、好気性微生物の活動を抑制して水域の浄化作用を低下させ、また水生生物の窒息死を招く。
一般に魚介類が生存するためには3mg/L以上、好気性微生物が活発に活動するためには2mg/L以上が必要で、それ以下では嫌気性分解が起こり、悪臭物質が発生する。

