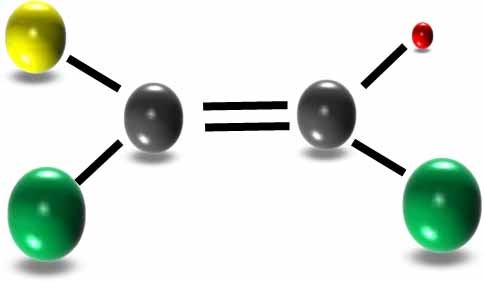
二重結合を含む平面に対して同じ側(シス)にあるか?
あるいは反対にあるか(トランス)?で構造が異なります。
二重結合は単結合とは違って回転しません
手は二本結合しているので回転しない!
というイメージがよく使われます実際には少し違いますが(後で説明)、
まずそう考えてみましょう
構造図では二本線で表します
炭素とカルボシル基と水素がついた形で説明します
回転できないのでシス型とトランス型で構造だけでなく性質や反応性も変わります
したがって名前も マレイン酸とフマル酸の様に異なる場合も少なくありません。
さて、二重結合についてもう少し詳しく見てみましょう。
炭素と炭素の二重結合のうち片方の結合は単結合と同じ結合
σ(シグマ)結合をしています。
もう一つの電子はπ(パイ)結合という結合をします
π結合は図示されるように上下に分かれてひとかたまりになっていて
上でも下でも結合している。σ結合よりは弱く反応性は高い。
このことから 二重結合での回転は起こらない。
また、結合は弱くきれやすい。つまり反応性が高い事につながっている。
二重結合が反応性が高いが二本とも切れることはないというのもσ結合とπ結合の関係によって生まれている。
↑
クリックしてみて!