荒川央博士がNOTE記事を更新されていた。
話題は、やはり、レプリコンワクチン関連だ。
獨協医科大学のグループが『レプリコンRNAが細胞に感染し得る事』を
培養細胞の実験で証明したとの論文が、virusesに掲載されたそうだ。
尚、NOTE記事の冒頭では、今秋からの定期接種B類(年1回 高齢者対応)では
レプリコンワクチンが予定されている と見越して書かれてあるけれど、
あくまでも予定 ではある。
ネット上で見かけた記事では、レプリコンの治験結果は芳しくないようだった。
記事元が解らず真偽不明だったので、私はブログ記事には載せていない。
ただ、従来のmRNAタイプの薬害も表沙汰になってきていることから、
秋からの定期接種には、敢えて危険なレプリコンタイプは使われないのでは?
と素人の私は、只の勘で予測している。
2回で終了だった筈が『ブースターが必要』となり、ゴールポストがずらされた。
信じられないけれど、『重症化を防ぐ』を信じて接種された人もいらっしゃる。
インフルエンザワクチンと同じ誘い文句が、何とも姑息な手法だと思っている。
でも本当に重症化を防ぐのか?の証明は無く、有耶無耶のままフェイドアウト?
解っているのは、世界中で過去最大の薬害が起きていること。 ただそれだけ。
8回目接種を行う予定の国は、日本のみ?!
世界じゅうで、その結果がどうなるか と密かに注目されているらしい。
私たち日本人は、治験対象者なんかじゃないよ。
真面目に生きて来た人を愚弄するにも ほどが有る。
圧政を知りながら覆す事ができないのは、世の大衆の常なのか…。
何だか悔しいね。
何の因果で、いつまでもこんなマヤカシがずっと続けられているんだろう?
レプリコンは細胞外小胞を介して細胞間感染し、増殖できる
: virusesに掲載された論文から
日本人を対象とした新型コロナワクチンとして、今年の秋から日本国内での接種開始
が予定されているレプリコンワクチン (自己増殖型mRNAワクチン、self-amplifying RNA vaccine) は
抗原遺伝子に加えて、RNA複製遺伝子を持った遺伝子製剤です。
レプリコンワクチンのゲノムは、元のRNAウイルスから細胞の受容体に結合するタン
パクを取り除き、ワクチンの抗原タンパクに置き換えたもので、
いわば、殻のないウイルスのような構造になっています。
コロナウイルスのスパイクタンパクは、
細胞の受容体に結合し、細胞への感染を媒介するタンパクです。
例えば、インフルエンザウイルスでは、ヘマグルチニンが、スパイクタンパク質と同様の役割を持ち、
他のウイルスでは、エンベロープ糖タンパクが、宿主細胞への感染接着と感染を媒介します。
では、細胞への感染を媒介するタンパクを持たない
レプリコンワクチンは、細胞に感染できないのでしょうか?
獨協医科大学の増田道明教授のグループは、
『レプリコンRNAが細胞に感染し得る事』を培養細胞の実験系で証明しました。
感染は細胞外小胞を介して起こり、レプリコンRNAは感染細胞内で増殖したのです。
https://www.mdpi.com/1999-4915/16/4/524
細胞外小胞による
フラビウイルスサブゲノムレプリコンゲノムとウイルスタンパク質の拡散
エクソソームなどの細胞外小胞 (EV) は様々なタンパク質や核酸を送達する事により、細胞間コミュニ
ケーションにおいて生理的な役割を果たす事が示されている。また、ある種のウイルスに感染した細胞
由来のEVは全長のウイルスゲノムを伝達し、EVを介したウイルスの増殖を齎す事が、幾つかの研究で
明らかにされている。しかし調製したEVに感染性ウイルス粒子が混入している可能性も否定できない。
本研究では、日本脳炎ウイルスおよびデングウイルス由来のサブゲノムレプリコンを保有し、複製コン
ピテントウイルスを産生しない細胞をEVドナーとして用いた。これらの細胞の培養上清に含まれるEV
は、様々な種類の他の細胞にレプリコンゲノムを移行できる事が示された。
またEVは、HeLa細胞、K562細胞のCD33およびTim-1/Tim-4とそれぞれ相互作用した後、主にマクロ
ピノサイトーシスによってレシピエント細胞に取り込まれる事も示された。本研究で用いた方法は感染
性ウイルス粒子の混入がない為、フラビウイルスゲノムがEVによって細胞から細胞へ移行できる事が明
確に示され、古典的な受容体媒介感染に加えて、この経路がウイルスの増殖と病原性に何らかの役割を
果たしている可能性が示唆された。
コロナウイルスは、一本鎖プラス鎖RNAウイルスですが、
この研究で使われたフラビウイルスも 同様です。
フラビウイルス科のウイルスは脊椎動物に広く分布し、多くは蚊やダニを介して感染します。
代表的なフラビウイルスにはデングウイルス、日本脳炎ウイルス、ジカウイルス、西ナイルウイルス、
黄熱ウイルスなどがあります。
著者らは日本脳炎ウイルス (JEV Muar株) デングウイルス (DENV NGC株) からレプリコンを作成しました。
レプリコンとは単一の複製起点から複製されるDNA分子またはRNA分子の事です。
これらのレプリコン (JM-PnLおよびDN-PnL) では、ウイルスのエンベロープタンパクが取り除かれ、
そして、感染を検出する為のルシフェラーゼ遺伝子が導入されています。ルシフェラーゼは蛍の発光遺
伝子で、光により酵素活性を検出し、レプリコン感染を光で定量化する事が可能となります。
これらのレプリコンが、エレクトロポレーションによってBHK細胞に導入されて、レプリコン保有細胞
株が樹立されました。 ※
この研究で使われたレプリコンRNAは抗原タンパクの代わりにルシフェラーゼ遺伝子を持ってますが、
それ以外の点では、レプリコンRNAの構造は、レプリコンワクチンと同様です。
細胞外小胞 (EV) は細胞間の輸送を担当し、細胞間コミュニケーションを媒介する小胞で、
殆どの細胞種は、細胞外小胞を産生し、放出する事が知られています。
細胞外小胞はエクソソーム (直径約40~100 nm) に加えて
マイクロベシクル (直径50~1000nm) などの構造も存在します。
エクソソームは多胞エンドソーム (MVE) 内で形成され、MVEが細胞膜と融合する事で放出されます。
一方、マイクロベシクルは細胞膜からの出芽によって形成され、この研究ではエクソソームとマイクロ
ベシクルを厳密に区別せずに、細胞外小胞として両者を共に取り扱っています。
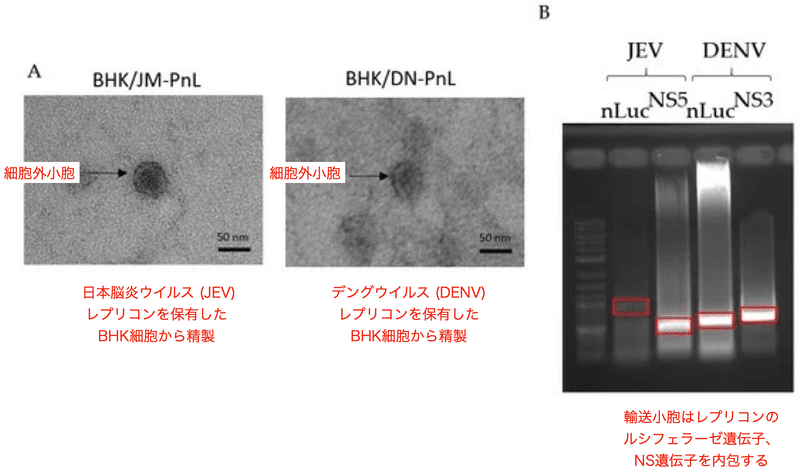
実験では、レプリコン保有細胞株の培養上清から細胞外小胞が精製されました。
電子顕微鏡の解析では、細胞外小胞の直径は約40 nmであり、
その形と大きさは、一般的な細胞外小胞と一致していました。 (図1A)
これらの細胞外小胞から抽出したRNAを逆転写し、PCR増幅すると
ルシフェラーゼ遺伝子やNS遺伝子が検出されました。 つまり レプリコン保有細胞株
から放出された細胞外小胞は、レプリコンRNAを含んでいました。 (図1B)
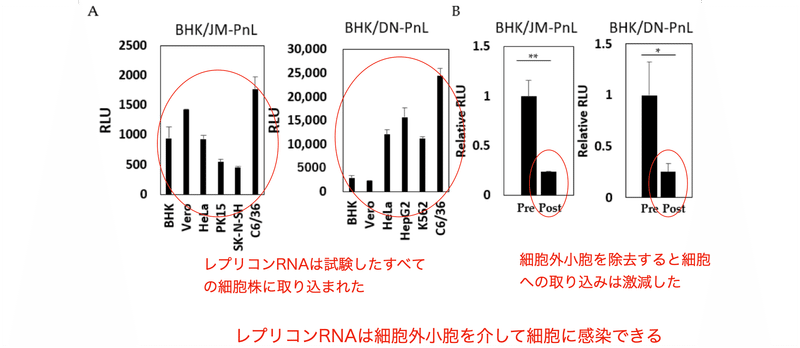
レプリコン保有細胞から調整した細胞外小胞をさまざまな細胞株に投与したところ、
すべての細胞株でルシフェラーゼ活性が検出され、 (図2A) 一方、培養浄清から
細胞外小胞を除去すると 細胞への取り込みは激減しました。 (図2B)
このように レプリコンRNAの細胞間感染は、
細胞外小胞によって媒介されている事が分かります。
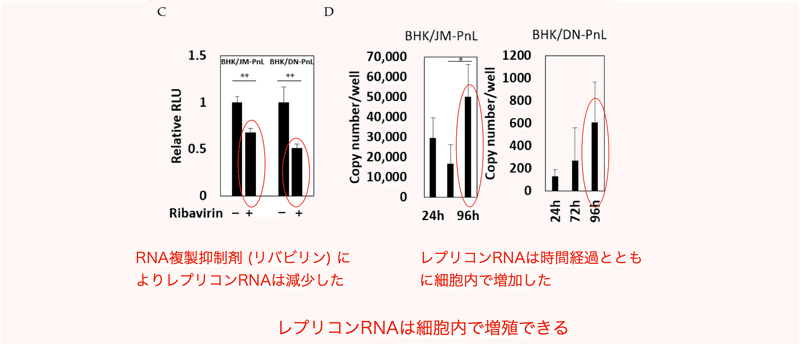
細胞外小胞を投与した細胞をRNA複製抑制剤 (リバビリン) で処理すると、ルシフェラーゼ活性は低下
し (図3C)、更にそうした細胞のレプリコンRNAをqPCRで定量すると、RNAは時間と共に増加したの
です。 (図3D)
この結果はレプリコンRNAを受け取った細胞内でRNAが増殖できる事を意味します。
著者らは更なる実験を行い、細胞間感染を媒介するタンパクや経路についても、解析しています。
RNAが細胞外小胞の細胞間感染を媒介するタンパクとしてはCD33、TIM1、TIM4などが関与している
ようです。これらは細胞表面受容体であり、免疫系の貪食やシグナル伝達に多様な役割を担います。
また、細胞への取り込みには、エンドサイトーシス が関与しています。
※ 。
通常 ウイルスはウイルス粒子として特異的な細胞の受容体に結合して感染します。
が、もう一つの経路として
細胞外小胞によるウイルス感染の可能性も 以前から指摘されていました。
しかし、これまでの研究は、ウイルス感染細胞由来の細胞外小胞を利用しており、
細胞外小胞に感染性ウイルス粒子が混入している可能性を 排除できませんでした。
しかし、今回の著者らの実験は、ウイルスを使用していない為に、
レプリコンその物が細胞外小胞を介して細胞に感染できる事を明確に示しています。
この研究は、細胞の受容体に結合するウイルスタンパクを
持たないレプリコンRNAが細胞間を伝播し、感染した細胞内
で増殖できることを証明した、極めて重要なものです。
レプリコンワクチンにも、
同様の作用機序が働くことが懸念されます。
