燃料電池の原理はすぐに忘れてしまう。
水の電気分解の逆だというのだがどこが逆か?
燃料電池
燃料電池は水素と酸素を利用した電池で,水の電気分解の逆の原理で発電する電池である。水の電気分解は,水に水酸化ナトリウムなどの電解質を溶解させて,これに電極を入れ電流を流し,水を分解する。
2H2O + 電気エネルギー → 2H2 + O2
実用化されている燃料電池では,電解質にリン酸を用いたものがある。
電池式 (-)Pt・H2 | H3PO4aq | O2・Pt(+)
負極(燃料極ともいう)上では触媒(反応を促進する物質)により,H2の一部がイオン化してH+となり,e-を放出する。正極(空気極ともいう)上では,流れてきたe-をO2とH+が受け取りH2Oとなる。
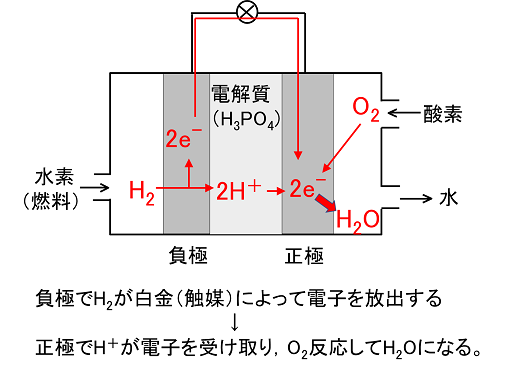 |
負極〔 H2 → 2H+ + 2e- 〕 正極〔 O2 + 4H+ + 4e-→ 2H2O 〕 全体〔 2H2 + O2 → 2H2O 〕 |
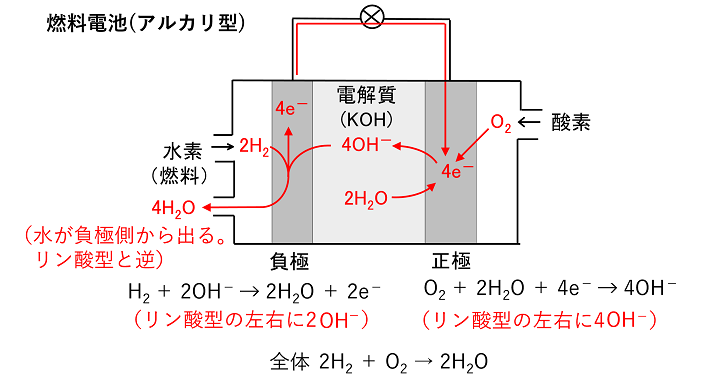
酸素と水素を供給してなぜ電気がおきるのか?
どうやら電極に白金をつかっていて
この白金が電子を放出するらしい。
この電子が回路に流れることで電力をつくるのだという。
白金自身は触媒なので変化はしない。
触媒というものは不思議なものだ。
電気(電子)を作るのにただ通り道になっているだけだ。
触媒はマジックだ。
ボルタ電池やダニエル電池の場合は電極が溶液にとけていて
その差が電圧の原動力になった。
物質にイオン化傾向に差があった。
触媒にはそれがない。
これが化学だ。
物理の頭では理解不能だ。