コロナ治療、コロナ後遺症治療に大活躍のイベルメクチン。
昨年1年間に300人以上の人に処方し、トータル処方錠数は5千錠を超えました。
まだまだニーズがあります。
最近はワクチン後遺症の患者さんの方が多くなってきました。
私たちがイベルメクチンを使用しているからでしょうか。
患者さんや一般の方からイベルメクチンの癌に対する効果についてお問い合わせを頂くことがよくあります。
私たちはイベルメクチンを癌治療に使った経験はありません。
だから文献を調べてみました。
まずは九大のプレスリリースを。
イベルメクチンが肝内胆管癌の治療薬となり得ることを発表しています。
MOB1欠損マウスやヒト肝内胆管がん細胞移植マウスを用いて個体レベルで証明しています。
詳しくはコチラをお読み下さい↓
そしてコチラは「breast cancer」という雑誌に掲載された「イベルメクチンはコールド腫瘍をホットに変換し、乳癌治療のための免疫チェックポイント遮断と相乗効果を発揮する」という論文です。
めっちゃ長い論文なので一部抜粋して要約しました↓
ーーーーーーーーーーーーーーーーー
概要
イベルメクチンが、免疫原性の癌細胞死(ICD)と乳房腫瘍へのT細胞浸潤を誘発する。
がん細胞と免疫細胞の両方で機能する ATP/P2X4/P2X7 軸のアロステリック モジュレーターとして、イベルメクチンは骨髄細胞や Treg などの免疫抑制集団を選択的に標的にし、Teff/Treg 比を高める。
どちらの薬剤単独でも in vivo での有効性は示されませんでしたが、イベルメクチンとチェックポイント阻害剤の抗 PD1 抗体との併用療法は、腫瘍増殖を制限する相乗効果を達成し、完全奏効を促進した。
原発腫瘍を超えて、この組み合わせは、ネオアジュバント ( p = 0.03) およびアジュバント治療後の再発の有意な減少、および転移性疾患の治癒の可能性を達成した。
統計モデリングにより、アジュバント ( p = 0.007) と転移設定 ( p < 0.001)の両方で真正な相乗効果が確認されました。
イベルメクチンは、乳癌において二重の免疫調節効果と ICD 誘導効果を持ち、冷たい腫瘍を熱く変換するため、チェックポイント遮断の合理的な機械的パートナーとなる。
序章
チェックポイント阻害薬は、患者自身の免疫系を利用してがんを治療する革新的なアプローチとして登場した。
しかし、単剤としてのチェックポイント阻害剤は、一部の患者とがんの種類にしか効果がない。
最近の研究では、チェックポイント阻害剤の有効性は主に、T 細胞がすでに浸潤しているがん (しばしば「ホット」腫瘍と呼ばれる) に限定される。
対照的に、「コールド」腫瘍は T 細胞浸潤がほとんどまたはまったくなく、一般にチェックポイント遮断に反応しない。
そのため、チェックポイント遮断と相乗効果を発揮するために、乳房腫瘍をプライミングする (「コールド」腫瘍を「ホット」にする) ことができる薬剤を特定する必要性がある。
免疫機能を抑制せずにがん細胞の ICD を誘導する薬剤は、チェックポイント遮断との組み合わせに最適。
FDA承認薬の中からそのような薬剤を探したところ、抗寄生虫剤であるイベルメクチンが乳癌細胞のICDを促進することを発見。
1975年以来世界中で使用されている抗寄生虫薬であるイベルメクチンが抗癌活性のために腫瘍の固有の高い細胞外レベルのATPをさらに活用する可能性があることを示唆している.
イベルメクチンが直接的な免疫調節効果を持っている可能性がある。
結果
イベルメクチンは「冷たい」乳房腫瘍を「熱く」することができる。
TNBCの4T1マウスモデルを使用して、in vivoでのイベルメクチンの効果を調べた。
イベルメクチンによる治療が 4T1 乳房腫瘍内で ICD の特徴を誘発し、これらの腫瘍に多数の CD4 +および CD8 + T 細胞を動員したことを示している。
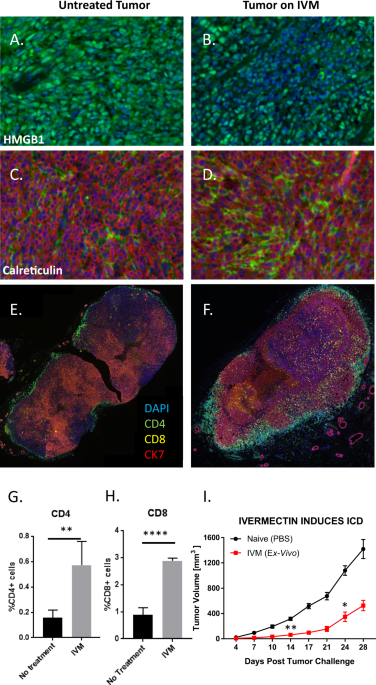
4T1乳房腫瘍は、14日間毎日、未治療(左パネル)またはイベルメクチン治療(右パネル)されたマウスから分離。
パネルA、Bは、ICDの特徴であるHMGB1(緑色)の染色を示しています。パネルC、Dは、ICD のもう 1 つの特徴であるカルレティキュリン (緑色) の染色を示している。
CK7 (赤) の染色は、4T1 細胞を識別する。
パネルE、Fは、CD4 + (緑)、CD8 + T 細胞 (黄)、および CK7 (赤) の染色による癌細胞の染色を示している。
パネルG、HE、Fに示されている T 細胞浸潤に関する定量的データを表示。
イベルメクチンの直接的な免疫調節効果
in vivoでのイベルメクチン処置は、処置動物の脾臓から単離された様々なエフェクターおよび調節性CD4(図S2A)またはCD8(図S2B )T細胞亜集団の頻度に有意な変化をもたらさなかった。
しかし、コントロール対 4T1 担癌マウスから分離された脾細胞の機能的調査により、有意な免疫調節効果が明らかになった。
担癌マウスは、接種後 1 ヶ月で、CD11b + GR-1 +骨髄由来サプレッサー細胞 (MDSC) と CD11b + GR-1の両方を含むCD11b +骨髄細胞の集団が拡大した脾臓の肥大を発症した (図2A )。
−単球/マクロファージ (Mon/Mac)。エクスビボでのイベルメクチン治療は、この拡大した CD11b +骨髄細胞集団を優先的に枯渇させ、骨髄細胞区画と T 細胞区画の間のバランスを正常化した (図2A )。
骨髄細胞集団とリンパ細胞集団は、増加する用量のイベルメクチンに対して異なる感受性を示した (図2BおよびS2C )。
細胞タイプに合わせて調整された対数細胞数の線形混合効果モデルは、CD11b +骨髄細胞がイベルメクチンに対して最も感受性が高く、48 時間後にわずか 4 μM、24 時間後に 8 μM、または 4 時間後に 16 μM という有意な減少を示すことが明らかになった。
h—この免疫抑制集団の迅速かつ選択的なターゲティングを示している (各結果、p < 0.0001)。
対照的に、CD4またはCD8 T細胞で同様の減少を達成するには、イベルメクチンへのより高い用量および/またはより長い暴露が必要だった。
がん細胞と免疫細胞の両方で機能する ATP/P2X4/P2X7 シグナル伝達軸のアロステリック モジュレーターであるイベルメクチンと一致して、骨髄細胞の異なる感受性は P2X7 依存性であった (図2C )。
10 μM KN62 による P2X7 遮断は、イベルメクチンによる CD11b + GR-1 + MDSC、CD11b + GR-1 - Mon/Mac、およびその他の免疫サブセットの ex vivo 枯渇を逆転させました ( p < 0.001)。
より生理学的に関連する暴露条件を模倣するために、脾細胞をより低い非細胞毒性用量のイベルメクチンで処理し、長期にわたる暴露で、イベルメクチンがフィトヘマグルチニン (PHA) 刺激 T 細胞に有意な増強効果をもたらし、両方の CD8 の比率を増強することを観察した。 (図2D)。
非細胞毒性の低い用量のイベルメクチンへの長期暴露による免疫増強効果は、TCR 刺激により (PHA を介して) 増強され、担癌マウスの脾細胞では抑制された (図2D ) 。
D年齢が一致した未処理およびナイーブの非担癌コントロール
イベルメクチンは抗PD1抗体と相乗作用して腫瘍の増殖を制御し、防御免疫を誘導する
イベルメクチンの抗がん ICD および直接的な免疫調節効果は、チェックポイント遮断と組み合わせることができる可能性を高めた。
次に、イベルメクチンと抗 PD1 抗体の有効性を、単独または組み合わせて、無治療と比較して調査 (図S1Aのスキーマ)。
経時的な平均腫瘍体積は、イベルメクチンと抗 PD1 抗体の組み合わせにより、無治療と比較して有意に減少 ( p < 0.001、図3A )。
縦方向の腫瘍体積の共同統計モデルを通じて、イベルメクチンと抗 PD1 抗体は、薬物の個々の効果の合計よりも有意に大きい効果として定義される相乗活性を示した (サブモデルp = 0.008、誤発見率/FDR 3% 、表1)。
完全な腫瘍退縮は、併用治療で 6/15 マウス、イベルメクチン単独で 1/20、抗 PD1 抗体単独で 1/10、無治療で 0/25 のマウスで観察された。
イベルメクチンと抗 PD1 の併用療法で腫瘍が消失したマウスは、反対側の乳房脂肪パッドに 100,000 個の 4T1 細胞を再チャレンジした。
これらのマウスはすべて新しい腫瘍の発生に抵抗したが(図3B )、対照のナイーブ動物はすべて腫瘍を発生した(データは示さず)。
これは、イベルメクチンと抗 PD1 を組み合わせた治療が、完全なレスポンダーに保護的な抗腫瘍免疫を誘導することを示唆している。
イベルメクチン単独 ( n = 20)、抗 PD1 抗体単独 ( n = 10)、両方の薬剤 ( n = 15)、または治療なし ( n = 25)による治療を開始する 4 日前に、マウスに 100,000 個の 4T1 細胞を接種。
A:対照動物および処置動物の腫瘍体積。
B:イベルメクチンと抗 PD1 抗体で処理した個々の動物の腫瘍増殖 (3 つの実験の 1 つの代表からの 5 つの個々のマウスを示す。
併用療法を受けた 5 匹の動物のうち 3 匹で、腫瘍が完全に消失。
腫瘍が消失した動物は、治療終了から 30 日後に、対側乳房脂肪体に 100,000 個の 4T1 細胞を再チャレンジ。
腫瘍塊を確立するために、マウスを観察し、週に 2 回、さらに 30 日間触診。
C :Fイベルメクチンと抗 PD1 の併用療法は、腫瘍部位により多くの T 細胞を動員し、腫瘍反応性 CD8 + T 細胞を生成。腫瘍は 21 日目にマウスから分離された。
染色は核 (青)、CD4 +(緑) 細胞、CD8 +細胞 (黄)、および腫瘍細胞 (赤) ( C )。
CD4またはCD8の陽性率は、各グループの5つのランダムなフィールドで測定され、フィールド内の核の数で割られた( D )。
データは 2 つの独立した実験の代表。
無処置 ( n = 5)、抗 PD1 単独 ( n = 5)、または抗 PD1 とイベルメクチン ( n = 4)を受けた担癌マウスから分離された脾細胞 を 4T1 細胞と共培養。
反応性CD8 +細胞は、フローサイトメトリーによるCD107動員およびIFNγの発現によって決定された。
各治療グループの代表的なフロー プロットをEに示す。
F:処理ごとに分類した、マウスあたりの 4T1 に対して反応するCD8 + T 細胞の割合。
併用治療の有効性の根底にあるメカニズムについてさらに洞察を得るために、イベルメクチン、抗PD1、およびそれらの組み合わせがT細胞の浸潤を増強する大きさを比較。
図3Cに視覚的に示され、図3Dに定量的に示されるように、4T1腫瘍へのCD4+およびCD8+T細胞の両方の浸潤(21日目)は、イベルメクチンと抗PD1の組み合わせによる治療後に最大であった。
抗腫瘍 T 細胞を測定するために、未処理、単剤処理、またはイベルメクチンと抗 PD1 併用処理マウスから脾細胞を分離し、ターゲットとして 4T1 細胞と共培養して、CD107 動員と IFN-γ 発現を測定。
機能性 T 細胞応答のマーカー22. 機能的な腫瘍特異的免疫応答は、CD107 および IFN-γ に対して陽性の CD8 + T 細胞の離散集団の存在によって確認された。コントロール ( p < 0.01; 図3E、F )。
IVM + IP 併用療法がネオアジュバント設定で効果的であり、レスポンダーにおいて潜在的により強力な防御的抗腫瘍免疫を誘導することが示唆された。
A:原発腫瘍の外科的切除後の動物の生存(腫瘍接種後16日目)。
B:80 日を超えて生存し、その後反対側の乳房脂肪体に 4T1 細胞を再チャレンジした処置マウスにおける防御免疫の誘導。
C:処置動物における 4T1 反応性脾細胞の IFNγ ELISPOT 分析。
D:イベルメクチン、抗 PD1、イベルメクチン + 抗 PD1 ± IL-2 (IP)、またはアジュバント設定のコントロールで処理したマウス (手術後 17 日目および全治療スケジュールの完了後) の in vivo 生物発光イメージング。
E:原発腫瘍量の外科的切除後のアジュバント設定での動物の生存、およびイベルメクチン、抗 PD1、イベルメクチン + 抗 PD1 ± IL-2 (IP)、またはコントロールで 2 日後に治療を開始した。
F:イベルメクチン、抗 PD1、イベルメクチン + 抗 PD1 ± IL-2 (IP)、またはコントロールで治療された、転移が記録されたマウスの in vivo 生物発光イメージング
G:イベルメクチン、抗PD1、イベルメクチン+抗PD1±IL-2(IP)、またはコントロールで治療された転移設定のマウスのカプラン・マイヤー生存分析。
抗PD1またはIVM単独では、生存率は未治療と変わらなかった。(図4E)。
イベルメクチンと抗 PD1 の組み合わせ (IL-2 の有無にかかわらず) で生存期間が大幅に延長され、約 40% の動物が長期生存となった ( 図4E )。
イベルメクチンと抗 PD-1 の組み合わせは、IVM または抗 PD-1 単独と比較して相乗効果が高いことが分かった。
興味深いことに、IL-2 の添加は、イベルメクチンと抗 PD1 の組み合わせによる生存利益をさらに増強しなかった 。
イベルメクチン単独での治療は未治療群と比較して生存期間を延長しなかった。
転移環境での生存に対する IVM と抗 PD-1 の併用効果は、IVM または抗 PD-1 単独と比較して非常に相乗的である。
イベルメクチンと抗 PD1 による治療 (IL-2 の有無にかかわらず) が転移状況でも有効であることを示している。
討論
結果は、イベルメクチンによる治療がICDの誘導を介して乳房腫瘍への強力なT細胞浸潤を誘導し、したがって「冷たい」腫瘍を「熱く」することを示している。
従来の化学療法薬とは異なり、この薬剤には宿主の免疫機能を抑制しないという利点があるが、むしろ有益な免疫調節効果があり、免疫チェックポイント遮断の有望な機械的パートナーとなっている。
イベルメクチンと抗 PD-1 チェックポイント遮断の相乗作用により、T 細胞の腫瘍微小環境への浸潤が促進されることは特に興味深い。
免疫原性がん細胞死を誘導し、免疫細胞を特異的に調節し、ATP に富む腫瘍微小環境を利用するイベルメクチンのこれらの多面的な効果が、in vivo での免疫チェックポイント遮断と相乗作用する能力にどのように寄与するかを解明するには、さらなる研究が必要。
免疫チェックポイント阻害剤 (ICI) は、がん患者の小さなサブセットでのみ単剤として有効。
イベルメクチンが免疫チェックポイント遮断の合理的なパートナーであり、どちらの薬剤も単独では機能しない場合の真の相乗効果を示した。
PD-1 遮断とイベルメクチンの相乗効果は、イベルメクチンが免疫原性癌細胞死と腫瘍への T 細胞浸潤を促進する能力と機構的に関連しており、「コールド」腫瘍を「ホット」に変換する。
イベルメクチンと PD-1 チェックポイント遮断の組み合わせにより、かなりの割合の動物で原発腫瘍が完全に退縮し、抗腫瘍免疫がもたらされた。
この新しい組み合わせが、転移例でも有効であることを実証した。
イベルメクチンは、がんにおけるその新しい二重の作用機序に基づいて、FDA が承認した他の ICI の抗腫瘍活性も増強する可能性がある。
最後に、イベルメクチンは安価であるため、開発途上国のがん患者を含むすべての人が利用できる。
私たちが提示した臨床所見は、イベルメクチンと抗 PD1 抗体の組み合わせが乳がん患者の臨床試験に値することを示唆している。
ーーーーーーーーーーーーーーーーー
原文はコチラ↓
この論文は乳癌に対するイベルメクチンの治療効果について、しかもチェックポイント阻害薬との併用における効果を書いたものです。
イベルメクチン単独では効果がなかったけれど、チェックポイント阻害薬との併用で有意に生存期間を延長しました。
イベルメクチンが癌に効くかどうかは臨床試験をやってみないと分からないでしょうが効果は期待できそうですね。
抗癌剤のような副作用もないですし、服用しても害はないでしょう。
またワクチン接種後のターボ癌は通常の癌と違ってスパイクタンパクによる影響があるので、スパイクタンパクの毒性を消去するイベルメクチンを服用することは意味があると思います。
Twitterではイベルメクチンで癌が小さくなったというtweetが散見されます。
イベルメクチンは本当に不思議な薬です。
コロナ後遺症、ワクチン後遺症、イベルメクチンに関するお問い合わせはコチラへお願いします↓
コロナ関連・ワクチン後遺症について
コチラからお問い合わせ頂いても構いません。
お問い合わせの際は「ブログを見た」とお伝え下さい。
患者さんのリクエストで復活させた
化粧品と発酵素するりの記事は
コチラ![]()
便通・腸を整えて美肌を目指す 元皮膚科・現役肛門科の女医が教えるキレイ術
2020年12月25日に出版し、おかげさまで9刷目となり累計発行部数が3万部を超えるベストセラーになりました![]()
オシリを洗っている全ての人に届けたい。
お読み頂けると幸いです。
公式LINEでも情報発信中