ご覧の通り。
567の猛毒ワクチンが出る前は、それまでの最悪と言われた毒チンです。
拡散希望!遂に男性へ・・・新潟県弥彦村
2022-07-24 10:54:43
https://ameblo.jp/carolyn-kidman/entry-12754996989.html
呆れまくりなので、消されたブログに出してあった記事をひとつ復活させます。
一部修正するかも。12年前に書いた記事です。タイトルは
↓
Friday, July 30, 2010
子宮頸癌を予防するかどうかの試験はしていない、「もしかしたら子宮頸癌を予防できるワクチン」 受ける女性はモルモット! 「やってみなければ分からない」「理解できない」「(GSKから)答えが得られていない」のに承認した厚労省
原因とは到底言えないウィルスを予防するために、加えてそれに感染した人の99.85%は子宮頸癌にならないというのに、そのうえ海外では多くの人々が 死亡を含む
有害副反応の被害を訴えているときに公費負担をして多くの女子に打たせる意味が 一体どこにあるのでしょうか?
正直に「利益相反に関する申出」をして「議決には参加」しなかった竹内委員だけが、その責任を免れられるかもしれません。同氏は、下に見られるように「倫理的に」問題があるのではないか?という指摘もされていました。ここで触れた数名の嘘つき医師とは大違いかと。
このあと9月29日に行われた薬食審・薬事分科会の議事録も見られるといいのですが、いずれにせよそこでも承認はおりたわけですから「問題視されなかった」ということですよね。
それこそが問題なんですが。
見やすさを考慮して改行を入れ、ところどころに私の疑問も入れました。
09/08/31 平成21年8月31日薬事・食品衛生審議会医薬品第二部会資料
薬事・食品衛生審議会 医薬品第二部会 議事録
1.日時及び場所
平成21年8月31日(月) 16:00~
厚生労働省共用第8会議室
2.出席委員(13名)五十音順
飯 沼 雅 朗、 庵 原 俊 昭、 守 殿 貞 夫、 清 水 秀 行、
竹 内 正 弘、 田 村 友 秀、 土 屋 友 房、 濱 口 功、
早 川 堯 夫、 前 崎 繁 文、 溝 口 昌 子、 山 添 康、
◎吉 田 茂 昭
(注)◎部会長 ○部会長代理
他参考人3名
欠席委員(4名)
新 井 洋 由、○池 田 康 夫、 岡 慎 一、○堀 内 龍 也
3.行政機関出席者
岸 田 修 一(大臣官房審議官)
成 田 昌 稔(審査管理課長)、
森 和 彦(安全対策課長)、
豊 島 聰(独立行政法人医薬品医療機器総合機構審査センター長)、
松 田 勉(独立行政法人医薬品医療機器総合機構安全管理監)、
平 山 佳 伸(独立行政法人医薬品医療機器総合機構上席審議役)、
赤 川 治 郎(独立行政法人医薬品医療機器総合機構審議役)、他
4.備 考
本部会は、企業の知的財産保護の観点等から非公開で開催された。
○審査管理課長 定刻になりましたので、「薬事・食品衛生審議会医薬品第二部会」を開催させていただきます。本日はお忙しい中御参集いただきまして、ありがとうございます。
現在のところ、当部会の委員数17名のうち11名の委員に御出席いただいておりますので、定足数に達していることを御報告します。また、新井委員、池田委員、岡委員、堀内委員より御欠席の御連絡をいただいております。飯沼委員、田村委員は後ほど遅れて来られるということであろうかと思っております。
本日の審議事項、議題2に関して、参考人として独立行政法人国立病院機構三重病院名誉院長の神谷齊先生をお呼びしております。また、その他の議題1に関して、参考人として群馬大学大学院医学系研究科の池康嘉先生、北里大学北里生命科学研究所の砂川慶介先生をお呼びしております。
それでは、部会長、よろしくお願いいたします。
○吉田部会長 それでは、本日の審議に入ります。事務局から配付資料の確認と、審議事項に関する競合品目・競合企業リストについて御報告をお願いします。
○事務局 資料の確認をさせていただきます。本日、席上に議事次第、座席表、当部会委員の名簿を配付しております。議事次第に記載している資料No.1~10までをあらかじめお送りしております。このほか、資料No.11「審議品目の薬事分科会における取扱い等の案」、資料No.12「専門委員リスト」、資料No.13「競合品目・競合企業リスト」を配付しております。また、当日配付資料として、資料No.1-2、審議議題1に関する「予診表(案)及び説明文書(案)」、資料No.3-2「正誤表」、資料No.10-2「申請会社の回答書に対する意見」を配付しております。
続きまして、本日の審議事項に関する「競合品目・競合企業リスト」について御報告します。競合品目選定理由については、資料No.13です。 1ページを御覧ください。本日の審議議題1「サーバリックス」に関しては、本剤の期待される効能・効果は「子宮頸癌等の予防」で、本邦でこの同種の効能・効果として現在承認申請中である1品目、具体的には万有製薬が申請しているワクチンを競合品目として挙げております。
2ページです。審議議題2「プレベナー水性懸濁皮下注」です。この品目は「肺炎球菌による侵襲性感染症の予防」の効能・効果を予定しているものです。本剤と同様の効能・効果を有している品目は現在ございませんが、「肺炎球菌による感染症の予防」を効能・効果としている「ニューモバックスNP」のみ国内で承認・販売されている同種・同効品目であることから、この品目が競合品目として挙げられております。
3ページを御覧ください。審議議題3「ラスリテック」です。本剤については、同種の効能・効果及び薬理作用を有する製剤が存在しないことから、競合品目はなしとされております。
4ページを御覧ください。審議議題4「オゼックス」です。本剤は、肺炎及び中耳炎の小児感染症において、薬剤耐性が問題になっているPISP、PRSP、BLNARなどの耐性菌対策を目標に開発されたフルオロキノロンです。本剤と同様に薬剤耐性菌対策を目標に開発された薬剤として、「クラバモックス小児用ドライシロップ」があります。また、小児感染症の薬剤として汎用されている薬剤としてセフェム系薬剤が競合品目の候補に挙げられております。以上のことから、これらについて売上高の多い順にメイアクト、フロモックス、セフゾン、バナンドライシロップなどがあることから、開発目的が同じ1品目「クラバモックス」及び売上高上位2品目である「メイアクト」と「フロモックス小児用細粒」を競合品目として挙げたということです。
5ページです。審議議題5「ベネフィクス静注用」です。本剤については、「血友病B(先天性血液凝固第IX因子欠乏症)患者における出血傾向の抑制」の効能・効果を予定しており、遺伝子組換え型の血液凝固第IX因子製剤です。本品目とほぼ同様な効能・効果及び作用機序を有するものとして、現在、人血液凝固第IX因子製剤としてこちらに掲げられている3品目が国内において承認されていることから、これら3品目を競合品目として選定したということです。以上でございます。
○吉田部会長 ただ今の事務局からの御説明について、特段の御意見、御質問はございますか。
ないようですので、本部会の審議事項に関する「競合品目・競合企業リスト」については、皆様の御了解を得たものといたします。それでは、各委員からの申出状況について御報告をお願いします。
なお、議題6については審議事項の議題1及び議題2に関連するものですので、各々一緒に御審議いただければと思います。
○吉田部会長 ありがとうございました。本日は審議事項が6議題、報告事項が3議題、その他が1議題となっております。
それでは、議題1、資料No.6-2について、医薬品機構から概要の説明をお願いします。
○機構 議題1、資料No.1、医薬品サーバリックスの製造販売承認の可否等につきまして、医薬品医療機器総合機構より御説明します。
本剤は、ヒトパピローマウイルス(以下、HPV)16型及び18型の外殻を構成するたん白質を、バキュロウイルス発現系を用いて昆虫細胞により産生させ、得られたウイルス様粒子たん白質を新規有効成分とするワクチンです。アジュバントとして、アルミニウムのほかにサルモネラ菌由来のリピドA誘導体であるモノホスホリルリピドAを含有しております。子宮頸癌の主な原因はHPVの感染とされておりますが、本剤は、主要な癌原性ウイルスとして知られているHPV-16型及び18型をターゲットとする子宮頸癌の予防ワクチンとして開発されております。
本剤は、2009年8月時点で、欧州など96か国で承認を取得しております。現時点において、本邦で既承認の類薬はなく、子宮頸癌予防対策の一つとしてHPVワクチンの臨床使用を求める医療上の要望及び社会的関心が高まっております(疑問:誰が関心を高めたの?)。このような背景を踏まえ、厚生労働省の指導により、国内臨床試験の終了を待たずに平成19年9月26日に本剤の製造販売承認申請がなされております。国内臨床試験成績については、10歳~15歳の健康女性を対象としたHPV-046試験の総括報告書が□年□月□日付けで提出され、また、20歳~25歳の健康女性を対象とした国内主要試験であるHPV-032試験の中間解析結果が□年□月に提出されました。審査チームは、この中間解析の結果に基づきHPV-032試験の評価を進め、□年□月□日付けで提出された最終総括報告書の内容と矛盾のないことを確認しております。(疑問:どうして年月日が3ヵ所も黒塗りで消されているの?)なお、本品目は、優先審査品目に指定されております。(疑問:「早く承認させろ!」という意味ですね? 誰がそういう指定をしたんですか?)
本品目の専門協議では、資料No.12に示す先生方を専門委員として指名させていただいております。
以下、本剤の有効性及び安全性について、臨床試験成績を中心に御説明します。
「子宮頸癌を予防するか
どうかの試験は
本邦においては、HPV-16及び18型による6か月以上の持続感染を指標に試験が実施されました。審査報告書35ページの表4にお示ししているように、持続感染が認められた例はいずれも対照群であり、ワクチンエフィカシーの99%信頼区間の下限は0を上回り、有意差が認められております。
低年齢層を対象とした試験については、国内、海外ともに免疫原性が指標とされております。国内臨床試験において、審査報告書37ページ表7にお示ししているように、本剤接種により、接種前の血清抗体の有無にかかわらず、自然感染時を大幅に上回る抗体価が得られております。また、海外臨床試験成績から、本剤の接種により、少なくとも数年間高い抗体価が維持されることが報告されております。(疑問:オーストラリアのワクチン・ネットワーク サイトにはガーダシルに限定しての話かもしれないけれども「接種後24ヶ月、つまり2年で抗体のレベルが低くなってしまった」と書いてあるのですが...)なお、現時点においては追加接種の要否については明らかになっておりません。また、試験成績から、HPV-16、18型以外のHPV型に対する予防効果は不明であり、また、既に感染している場合の有効性は期待できないと判断しております。
(疑問:「期待できない」どころではなく、「マイナスの効果=重度の前癌状態に
なる可能性が32%強ある」とグラクソのデータにでているんですけれども、
ご存知ない?)
しかし、本剤はToll-like receptor4のリガンドであり、自然免疫応答の活性化への寄与が知られる新規アジュバント成分であるモノホスホリルリピドAを含有すること、また、昆虫細胞をたん白質発現細胞として用いた本邦初の遺伝子組換え製剤であること等を踏まえますと、特に慎重に安全性情報を収集し、適切に情報提供していくことが重要と考えております。
製造販売後には、審査報告書65ページ中ほどにお示ししておりますが、日本人における長期の有効性及び安全性に関連する情報収集のために、HPV-032試験の被験者を対象とした長期追跡調査の臨床試験としての実施が予定されております。また、1,000例を対象に全3回接種の情報を収集する使用成績調査の実施が併せて予定されております。
以上のとおり、機構での審査の結果、効能・効果を「ヒトパピローマウイルス16型及び18型感染に起因する子宮頸癌及びその前癌病変の予防」として本剤を承認して差し支えないとの結論に達し、医薬品第二部会で審議されることが適当と判断しました。本剤は新有効成分含有医薬品であることから、再審査期間は8年が適当と判断しております。また、原体、製剤とも劇薬に該当すると判断しております。本剤は、種としてはヒトから遠いバキュロウイルス-昆虫細胞系を用いて製造されますが、このような発現系を用いて製造される本邦初の医薬品であり、使用経験に基づくウイルス安全性担保に関する情報には限界があることを踏まえ、生物由来製品とすることが適当と判断しております。薬事分科会では審議を予定しております。
○吉田部会長 ありがとうございました。それでは、委員の先生方から御質問、御意見等お願いします。
○庵原委員 二点お聞きしたいのですが、ワクチンを3回打ったあとの昆虫細胞に対する抗体は検出されなかったのかというのが一点です。というのは、昆虫細胞の安全性という意味で、これを見るとそのようなデータがなかったような気がしたので、それが一点です。
それから、これはアジュバントに水酸化アルミとMPLが使われているのですが、MPLだけのアジュバント効果が基礎データにはないのです。なぜ二つ加えなければいけなかったのか、その辺の根拠みたいなものについてメーカー側から情報はありますでしょうか。この二点を教えて下さい。
○機構 昆虫細胞に対する抗体については、ある程度検出はされております。しかし、本剤の接種によって特段上がるとは、現時点で報告されておりません。一点目はそれでよろしいでしょうか。
○庵原委員 というのは、今、インフルエンザワクチンもバキュロ系で発現したものが日本でも作られようとしています。そうしたときに、抗体が産生されたときにバキュロで発現されたインフルエンザワクチンを打つと、さらに悪くなるのかならないのかとか。今後バキュロ型で出てくるワクチンが増えると思いますので、これはこれでいいのですが、そのほかのワクチンを打ったときに、これに対する抗体がさらに上積みされるのかどうか。その辺りの情報は、やってみなければ分からないですね。
○機構 おっしゃるとおり、その辺りはやってみないと分からないことかと思いますが、少なくともサーバリックスを打っている時点で抗体の異常な上昇は見られていないというところです。
(疑問:それが数年、数十年後にどういう変化が見られるかは、どこまでフォローしたのでしょう?)
第二点のMPLの単独での検討ですが、少なくとも私どもで確認している中では、御覧になったとおり常にMPLとアルミニウムと一緒の検討結果になっております。なぜ臨床でMPL単独でやっていないのかという点については、今この時点では正確には分かりません。
○庵原委員 もし情報があれば教えてください。というのは、MPLがTh1型で動いて、水酸化アルミはTh2型で動きます。それを二つ混ぜることがどういう意味を持っているのか、そこが理解できないのです。
○機構 実は、GSKとしては、正に御指摘いただいたTh1とTh2と両方の効果を意図してMPLを配合しているという背景があります。
○吉田部会長 ほかにございますか。
○竹内委員 海外の有効性について教えていただきたいのですが、審査報告書45ページの表17の見方ですが、審査報告書45ページでは中間解析をやるので、O'Brien-Flemingという方法でP値が0.021と0.039と設定されたと。ところが、表17ではP値が0.0001と非常に有効性が出ているにもかかわらず、止めないで最終まで行ったという点を教えていただきたいと思います。
もう一つは、本当に初めから中止することを想定されない場合に、どうしてこういうP値を選んだのか。というのは、40ページの第II相試験では、同じようなバウンダリを使いながら0.005、0.005で、最終的に0.046というやり方で計算しますので、もし自分が統計としてこれに関わってきている場合には、もう少しP値を小さくして、止めなくして後ろでというデザインをするので、どうしてこういうデザインをしたのかなということと、会社側がやろうとされていることと少し矛盾しているのかなという点が疑問がありましたので、その辺りの経緯を教えていただけると助かります。
○機構 なぜそのようなスケジュールにしたのかとか、その辺りは私どもも何度かGSKに問い合わせております。明確なこちらで 納得できるような答えが
得られていないのが実情なのです。ただ、中間で見て、そこでやめなかったことについては、本剤の場合長期の有効性・安全性が重要になってくる製剤だと考えておりますので、長期に追っていただく分には良いのかと考えております。
○吉田部会長 竹内先生、決定的な問題になりますか。
○竹内委員 もし、これだけ差があった場合、倫理的にどうなのかなと。確実にワクチンの方が効いているにもかかわらず、トライアルをやり続けたということで議論されているのかなというのが疑問に思いました。有効的な面ではないのですが、
倫理的にどうかなと。
○吉田部会長 本来は有効中止でもよかったのではないかということですね。
○竹内委員 はい。
○濱口委員 一つ教えていただきたいのですが、このワクチンが実際に効いたか効いていないかを最終的に判断できるのは、がんができたかできないかということになってくると、例えば10代の女性に接種したあとに、40代ぐらいにならないとはっきりとした効果が判定できないということだろうと思うのです。そうしたときに、販売後の調査においてもう少し明確に、10年後、20年後といったところまでフォローするような綿密な計画が必要かなという気がするのです。そこはどうなっているのでしょうか。
○機構 長期の有効性、安全性についてもですが、確認が必要な製剤という御指摘はそのとおりだと考えております。実際にそういった調査・研究が可能であれば非常に有用だと考えております。ただ、具体的にどのように進めていくかは、例えば先ほど御説明した長期の追跡調査として実施する063試験は、2年間は追っていただくことになっているのですが、一方で竹内委員から御指摘があったように両方の効果を本当に示すとなると、プラセボ群なりを置く必要が出てくるのかもしれませんし、そういったところでなかなか長期にわたる試験は難しいと考えております。臨床研究のような形で実施されればよいと考えておりますが、まだ具体化していないのが現状です。(疑問:接種を受けた人々のフォローをやりさえしなければ、どれほど多くの人々が似たような有害事象を経験するか、全然わかりませんものね?)
○溝口委員 血清抗体価の上昇が書かれていますが、細胞性免疫、CTLなどの上昇は海外にデータがあるのでしょうか。
○機構 どの試験でどの程度の項目ということは資料を確認しませんと明確にはお答えできませんが、少なくとも副次ですとか探索的に評価されております。
○溝口委員 もう一つ、資料1-2に「子宮頸癌予防ワクチン接種をご希望の方へ」と書いてありますが、副作用がなくて、
もしかしたら
子宮頸癌を予防
○生物第二部長 現時点では、特段の方策はメーカーに確認しておりませんが、先生としては、臨床現場にそのような情報が行った方が有り難いという御指摘でしょうか。
○溝口委員 はい。できれば臨床現場に情報を流していただきたいと思います。
○生物第二部長 分かりました。メーカーの方にそのような御意見があったことをお伝えします。適切に情報提供がなされるように指導していきたいと思います。
○吉田部会長 ほかにございますか。競合品目等の位置付けというか、本薬と競合品目の使い分け、位置付けは何か言われているのですか。
○機構 現時点では、類薬はまだ承認されていないこともあって、それが承認された時点で検討していくことになるかと思います。
○吉田部会長 ほかに御意見はございますか。
二点目として、審査報告書64ページで、接種回数の選択のところで112日目に3回目の接種があり、0、1、6か月の接種スケジュールがその後設定されたことについて、「112日目は6か月目」ではないということで御質問をいただいております。御指摘のとおり、112日目は6か月目ではなく、審査報告書にお示しした002試験は、2回接種に加えて3回目の接種をしたとき応答が増強することを確認した試験です。GSK社ではほかのワクチンを対象に、0、1、2か月と0、1、6か月で接種スケジュールの検討を行い、その結果、0、1、6か月の接種スケジュールが選択されております。
○溝口委員 先ほど情報提供をとお願いしましたが、これは20年後、経過を長く追わないと本当の効果が分からないということで、もしかしたら会社は情報提供がしにくいのかもしれません。情報提供されるときは、その点も含めて情報提供していただきたいと思いますので、よろしくお願いします。
○機構 ありがとうございます。
○吉田部会長 ありがとうございました。ほかにコメントはありませんか。
それでは、議決に入ります。なお、竹内委員におかれましては、利益相反に関する申出に基づきまして、議決への参加を御遠慮いただくことといたします。本議題について承認及び改正を可としてよろしいでしょうか。
御異議がございませんので、承認及び改正を可とさせていただきます。なお、本剤は新有効成分であり、かつ既存の類薬がありませんので、薬事分科会に上程し審議することとさせていただきます。また、生物学的製剤基準の改正につきましては、薬事分科会に報告とさせていただきます。ありがとうございました。
それでは、議題2に入ります。
(以下、略)
http://www.mhlw.go.jp/shingi/2009/08/txt/s0831-1.txt
サーバリックスの認可がこんな調子ですから、
最後のクリックといいねもよろしく!
常連読者にはお馴染みだが、日本ではまだまだ知られていない我々の現実も
↓
<政府は会社>だから、本来の政府の持つ権限はゼロ
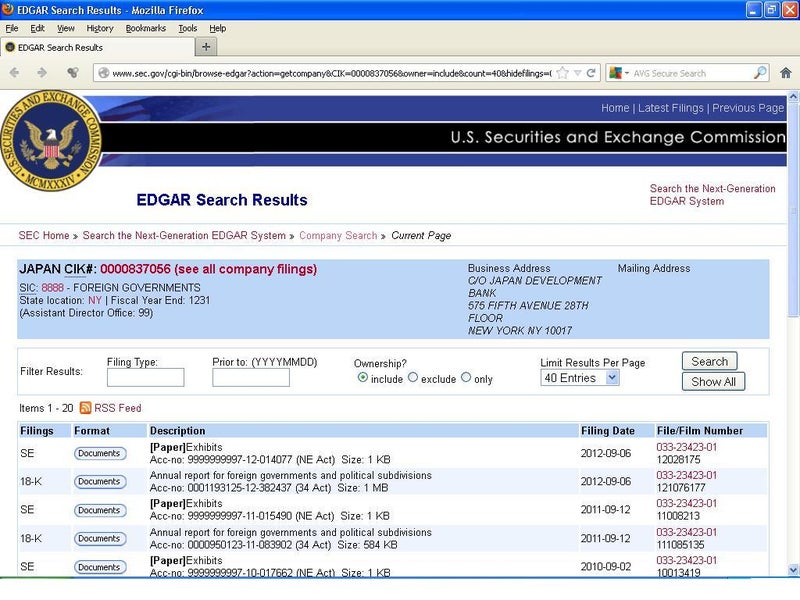
↑米国証券取引委員会の「会社検索」で出てくる「日本(政府)」という名の会社
http://www.sec.gov/cgi-bin/browse-edgar?action=getcompany&CIK=0000837056&owner=include&count=40&hidefilings=0
従って、奴等の法律や命令等々は完全に無効だ!!
おまけに<会社>にされていなくても<政府>というシステム自体が詐欺だから
(選挙で人々から政治力・政治的な責任を盗み取ってやりたい放題)
それを変えないと、本当の解決は得られない。とにかく手始めに
奴等の詐欺を逆用して全部ひっくり返すべきときです。
SNSだけじゃなくて、実社会で拡散を!!
そしてシークレットも忘れずに
↓

(上は、私が 毎日欠かさず言ってるヴァージョン)
これを毎日何度でも、感謝と歓喜の感情を込めて
言って&広めてください。
上のでも まだ長過ぎる!!と思う方は、超・短縮型

だけでもいいですから、毎日 何度でも連呼して 反撃を!!
★ブログ・ランキングのクリックよろしく!!
![]()
ニュース全般ランキング
★転送・転載は、この記事のタイトルとURLを!
全文の転載はご遠慮願います&長文の引用もお断りしています。




