御嫡男様の薬話、今回は、選択的セロトニン再取込み阻害薬(SSRI) フルボキサミンマレイン酸塩(デプロメール)
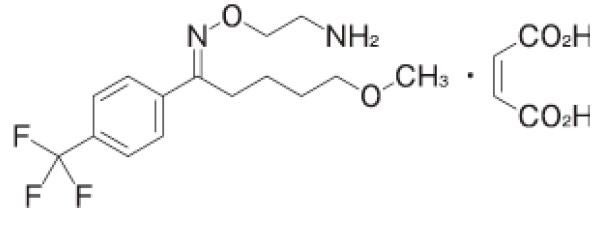
1970 年代の初め、オランダSolvay Pharmaceuticals 社(当時Philips Duphar 社、現Abbott Products社)の研究員であるV.Claassen らは、化学構造中にベンズケトオキシムを有する一連の化合物がモノアミンの再取り込み阻害作用を示すことを見い出しました。1977 年、ノルアドレナリンの再取り込みはほとんど阻害しないが、セロトニンの再取り込みを選択的に阻害する化合物フルボキサミンマレイン酸塩(以下、フルボキサミン)を発見しました。その後の薬理研究により、フルボキサミンはアドレナリン、ムスカリン、ヒスタミンをはじめとする種々の受容体親和性がほとんどないことが明らかになり、副作用の軽減された抗うつ薬となり得る可能性が示されました。
フルボキサミンのうつ病及びうつ状態に対する開発は、原開発国であるオランダを中心に主に欧州で行われ、1983 年よりスイス、フランス、ドイツ、オランダ、英国、スウェーデン、カナダ等で承認を得ました。一方、強迫性障害に対しては、1987 年から米国で実施された2 つのプラセボ対照二重盲検比較試験の結果から1994 年FDA より適応が認められ、英国、カナダ、スイス、オランダ、スウェーデン、ドイツ等でも適応を取得しました。
日本では選択的セロトニン再取り込み阻害作用を作用機序とする抗うつ薬は承認されていなかったこと、強迫性障害に対する治療薬がなかったことから、1989 年4 月より開発が開始され、「うつ病・うつ状態」、「強迫性障害」に対する有用性が認められ、1999 年4 月に承認されました。
さらに、海外において「社会不安障害(Social Anxiety Disorder: SAD)」に対する有効性が示されていることから、国内でもプラセボ対照比較試験が実施された。その結果、2005 年10 月に本邦初の「社会不安障害」に対する効能・効果を取得しました。
その後、承認用量である150mg/日(2 分服)を投与する際のコンプライアンスを高めるために、これまでのデプロメール®錠25(1 錠中25mg 含有)及びデプロメール®錠50(1 錠中50mg 含有)に加え、1回1 錠で服用できる新たな剤形規格としてデプロメール®錠75(1 錠中75mg 含有)が開発され、2008 年3 月に承認されました。
厚生労働省薬食審査発第0806001 号「我が国における医薬品の一般的名称の変更について(その1)」(平成19 年8 月6 日付)に基づき、一般的名称をマレイン酸フルボキサミンから「フルボキサミンマレイン酸塩」に変更されました。
「フルボキサミンマレイン酸塩」及び「フルボキサミンマレイン酸塩錠」は2011 年4 月第十六改正日本薬局方に収載されました。
2011 年4 月の「医療上の必要性の高い未承認薬・適応外薬検討会議」で、小児の強迫性障害の治療におけるフルボキサミンの医療上の必要性が高いと判断され、この検討結果から、厚生労働省より小児の強迫性障害に対する開発要請がされ、この要請を受けて2013 年から小児の強迫性障害患者を対象とした二重盲検比較試験が開始されました。その結果、有用性が認められ、2017 年7 月に小児に対する強迫性障害の用法・用量の追加が承認されました。
また、以下の効能・効果において承認拒否事由のいずれにも該当しないとの再審査結果を得ました。
うつ病・うつ状態、強迫性障害(成人への投与)、社会不安障害: 2014 年6 月27 日(再審査結果通知年月日)強迫性障害(小児への投与): 2022 年6 月24 日(再審査結果通知年月日)