2021/01/15
成体の細胞は謎に満ちているというストリー マクロファージの起源の謎を書いたら、ため息さんは全くの初耳のようでした。
まあ、ため息さんは、内、中、外胚葉由来臓器の話しか知らない方なので、こうした反応をするのも仕方ないでしょうね。
胎児が生育途上で、胎児細胞が循環して局所に生着し、大人になってからもその細胞が機能しているというストリーは、ため息さんには寝耳に水でしょう。
学とみ子の妄想としか考えないのです。
ため息さんが妄想と叫べば、ため息ブログメンバーも皆、妄想と思う集団です。
せっかくの勉強のチャンスなのに惜しいですね。
ため息さんは、脳細胞の専門家だったという話を聞いたことがあるのですが(間違っていたらごめんなさい)、実は脳のグリア細胞の起源も、胎生期に脳に到達した細胞ということです。
これについて書かれた日本語のサイトは以下です。青字
京都薬科大学統合薬科学系 高田 和幸氏著です。
図表もありますので、興味ある方はクリックしてください。
長らくその前駆細胞は末梢血中の単球と考えられてきたが、今から10 年前、胚体外組織の卵黄嚢での造血により作られる「原始マクロファージ」であることがマウスを用いた実験で明らかとなった 1)。この原始マクロファージ は、erythro-myeloid progenitors(EMPs)と呼ばれる細胞から転写因子 Myb 非依存的 2)に単球を経ず発生し、脳を含む全身の各臓器に生着して一時的に組織マクロファージとなる(図)。
他にも、いろいろ、マクロファージに関しては、多能性の意味から興味深いことがあるので、勉強していきましょう。
以下の図は、Florent Ginhouxと Martin Guilliams著による論文
Tissue-Resident Macrophage Ontogeny and Homeostasis の一部です。
マクロファージのでき方は多々あって、それぞれ臓器ごとに起源が異なるという論文です。
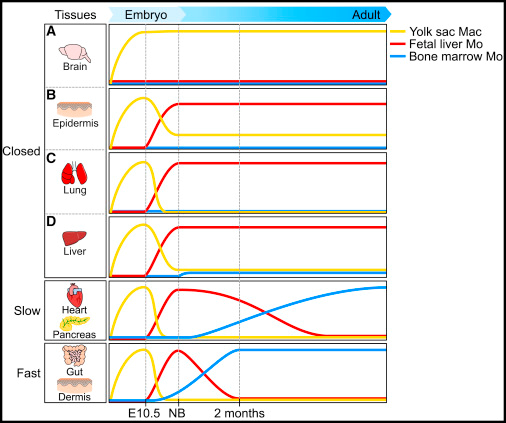
図の説明です。YSは卵黄嚢です。
Tissue-resident macrophages in closed tissues might arise only from YS macrophages (A, microglia), from both YS macrophages and fetal liver (FL) monocytes (B, Langerhans cells that have been shown to have a mixed contribution with around 20% of YS macrophages and 80% FL monocytes), or mostly from FL monocytes (C, alveolar macrophages and D, Kupffer cells). Note that for Kupffer cells, a minor contribution of neonatal monocytes and YS macrophages was suggested. For open tissues, bone marrow-derived monocytes are recruited and differentiate into macrophages with a kinetic specific to each tissue, with slow (heart and pancreas) and fast (gut and dermis) kinetics of replacement evidenced.
Abstract
Defining the origins and developmental pathways of tissue-resident macrophages should help refine our understanding of the role of these cells in various disease settings and enable the design of novel macrophage-targeted therapies. In recent years the long-held belief that macrophage populations in the adult are continuously replenished by monocytes from the bone marrow (BM) has been overturned with the advent of new techniques to dissect cellular ontogeny. The new paradigm suggests that several tissue-resident macrophage populations are seeded during waves of embryonic hematopoiesis and self-maintain independently of BM contribution during adulthood. However, the exact nature of the embryonic progenitors that give rise to adult tissue-resident macrophages is still debated, and the mechanisms enabling macrophage population maintenance in the adult are undefined. Here, we review the emergence of these concepts and discuss current controversies and future directions in macrophage biology.
尚、丹羽先生たちも、このマクロファージ領域の研究をしています。
タイトル”Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages”
この2020年の Cell Death Discov. 2020; 6: 63.の 論文は、骨髄由来の単球に人工的な条件付けをすることにより、自己複製可能なマクロファージを誘導できたという論文です。
Introduction
It was believed that tissue-resident macrophages in an adult are maintained by a constant replenishment by bone marrow-derived circulating monocytes in the steady state, and the monocyte-derived macrophages are non-proliferating cells1. However, recent studies have shown that macrophages in several tissues were derived from the precursors in yolk sac or fetal liver independently of bone marrow, and self-maintained throughout life2,3. Although the relative contribution of these precursors in the yolk sac, fetal liver, or bone marrow to maintain macrophage pool in each tissue is not fully understood4, embryo-derived counterparts are supposed to be more important because of their self-renewing ability.
Abstract
Recent studies have revealed that tissue macrophages are derived from yolk sac precursors or fetal liver monocytes, in addition to bone marrow monocytes. The relative contribution of these cells to the tissue macrophage pool is not fully understood, but embryo-derived cells are supposed to be more important because of their capacity to self-renew. Here, we show the presence of adult bone marrow-derived macrophages that retain self-renewing capacity. The self-renewing macrophages were readily obtained by long-term culture of mouse bone marrow cells with macrophage colony-stimulating factor (M-CSF), a key cytokine for macrophage development. They were non-tumorigenic and proliferated in the presence of M-CSF in unlimited numbers. Despite several differences from non-proliferating macrophages, they retained many features of cells of the monocytic lineage, including the differentiation into dendritic cells or osteoclasts. Among the transcription factors involved in the self-renewal of embryonic stem cells, Krüppel-like factor 2 (KLF2) was strongly upregulated upon M-CSF stimulation in the self-renewing macrophages, which was accompanied by the downregulation of MafB, a transcription factor that suppresses KLF2 expression. Indeed, knockdown of KLF2 led to cell cycle arrest and diminished cell proliferation in the self-renewing macrophages. Our new cell model would be useful to unravel differences in phenotype, function, and molecular mechanism of proliferation among self-renewing macrophages with different origins.
もうひとつ紹介しておきます。2013年の名古屋大学の研究論文です。
この論文では、マクロファージ起源について理論が変更されつつある状態が語られています。
研究エビデンス集積を背景に、従来理論への懐疑論が勢いづき、入れ替わる経過が書かれています。
タイトル”Establishment of self-renewable GM-CSF-dependent immature macrophages in vitro from murine bone marrow”
In adults, hematopoietic stem cells (HSCs) give rise to most macrophages and they are replaced continually by macrophage and DC precursors [4,5]. In adult mammals, HSCs also give rise to circulating monocytes. All resident macrophages in tissues may be derived from circulating monocytes [2]. However, this model of the development of the MPS has been challenged recently. In vertebrate embryos, two different types of hematopoietic cells can give rise to macrophages [6,7]. In mice, on embryonic day 8 (E8), the yolk sac (YS) gives rise to macrophages [8]. Then, definitive HSCs emerge from the mouse hematogenic endothelium of the aorto-gonadal-mesonephros region at E10.5 [9,10]. At later times, the fetal liver is the source of definitive hematopoiesis that generates circulating monocytes during embryogenesis. Coincident with the postnatal formation of bone, fetal liver hematopoiesis declines and is replaced by BM hematopoiesis.
まあ、ため息さんは、内、中、外胚葉由来臓器の話しか知らない方なので、こうした反応をするのも仕方ないでしょうね。
胎児が生育途上で、胎児細胞が循環して局所に生着し、大人になってからもその細胞が機能しているというストリーは、ため息さんには寝耳に水でしょう。
学とみ子の妄想としか考えないのです。
ため息さんが妄想と叫べば、ため息ブログメンバーも皆、妄想と思う集団です。
せっかくの勉強のチャンスなのに惜しいですね。
ため息さんは、脳細胞の専門家だったという話を聞いたことがあるのですが(間違っていたらごめんなさい)、実は脳のグリア細胞の起源も、胎生期に脳に到達した細胞ということです。
これについて書かれた日本語のサイトは以下です。青字
京都薬科大学統合薬科学系 高田 和幸氏著です。
図表もありますので、興味ある方はクリックしてください。
長らくその前駆細胞は末梢血中の単球と考えられてきたが、今から10 年前、胚体外組織の卵黄嚢での造血により作られる「原始マクロファージ」であることがマウスを用いた実験で明らかとなった 1)。この原始マクロファージ は、erythro-myeloid progenitors(EMPs)と呼ばれる細胞から転写因子 Myb 非依存的 2)に単球を経ず発生し、脳を含む全身の各臓器に生着して一時的に組織マクロファージとなる(図)。
他にも、いろいろ、マクロファージに関しては、多能性の意味から興味深いことがあるので、勉強していきましょう。
以下の図は、Florent Ginhouxと Martin Guilliams著による論文
Tissue-Resident Macrophage Ontogeny and Homeostasis の一部です。
マクロファージのでき方は多々あって、それぞれ臓器ごとに起源が異なるという論文です。

図の説明です。YSは卵黄嚢です。
Tissue-resident macrophages in closed tissues might arise only from YS macrophages (A, microglia), from both YS macrophages and fetal liver (FL) monocytes (B, Langerhans cells that have been shown to have a mixed contribution with around 20% of YS macrophages and 80% FL monocytes), or mostly from FL monocytes (C, alveolar macrophages and D, Kupffer cells). Note that for Kupffer cells, a minor contribution of neonatal monocytes and YS macrophages was suggested. For open tissues, bone marrow-derived monocytes are recruited and differentiate into macrophages with a kinetic specific to each tissue, with slow (heart and pancreas) and fast (gut and dermis) kinetics of replacement evidenced.
Abstract
Defining the origins and developmental pathways of tissue-resident macrophages should help refine our understanding of the role of these cells in various disease settings and enable the design of novel macrophage-targeted therapies. In recent years the long-held belief that macrophage populations in the adult are continuously replenished by monocytes from the bone marrow (BM) has been overturned with the advent of new techniques to dissect cellular ontogeny. The new paradigm suggests that several tissue-resident macrophage populations are seeded during waves of embryonic hematopoiesis and self-maintain independently of BM contribution during adulthood. However, the exact nature of the embryonic progenitors that give rise to adult tissue-resident macrophages is still debated, and the mechanisms enabling macrophage population maintenance in the adult are undefined. Here, we review the emergence of these concepts and discuss current controversies and future directions in macrophage biology.
尚、丹羽先生たちも、このマクロファージ領域の研究をしています。
タイトル”Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages”
この2020年の Cell Death Discov. 2020; 6: 63.の 論文は、骨髄由来の単球に人工的な条件付けをすることにより、自己複製可能なマクロファージを誘導できたという論文です。
Introduction
It was believed that tissue-resident macrophages in an adult are maintained by a constant replenishment by bone marrow-derived circulating monocytes in the steady state, and the monocyte-derived macrophages are non-proliferating cells1. However, recent studies have shown that macrophages in several tissues were derived from the precursors in yolk sac or fetal liver independently of bone marrow, and self-maintained throughout life2,3. Although the relative contribution of these precursors in the yolk sac, fetal liver, or bone marrow to maintain macrophage pool in each tissue is not fully understood4, embryo-derived counterparts are supposed to be more important because of their self-renewing ability.
Abstract
Recent studies have revealed that tissue macrophages are derived from yolk sac precursors or fetal liver monocytes, in addition to bone marrow monocytes. The relative contribution of these cells to the tissue macrophage pool is not fully understood, but embryo-derived cells are supposed to be more important because of their capacity to self-renew. Here, we show the presence of adult bone marrow-derived macrophages that retain self-renewing capacity. The self-renewing macrophages were readily obtained by long-term culture of mouse bone marrow cells with macrophage colony-stimulating factor (M-CSF), a key cytokine for macrophage development. They were non-tumorigenic and proliferated in the presence of M-CSF in unlimited numbers. Despite several differences from non-proliferating macrophages, they retained many features of cells of the monocytic lineage, including the differentiation into dendritic cells or osteoclasts. Among the transcription factors involved in the self-renewal of embryonic stem cells, Krüppel-like factor 2 (KLF2) was strongly upregulated upon M-CSF stimulation in the self-renewing macrophages, which was accompanied by the downregulation of MafB, a transcription factor that suppresses KLF2 expression. Indeed, knockdown of KLF2 led to cell cycle arrest and diminished cell proliferation in the self-renewing macrophages. Our new cell model would be useful to unravel differences in phenotype, function, and molecular mechanism of proliferation among self-renewing macrophages with different origins.
もうひとつ紹介しておきます。2013年の名古屋大学の研究論文です。
この論文では、マクロファージ起源について理論が変更されつつある状態が語られています。
研究エビデンス集積を背景に、従来理論への懐疑論が勢いづき、入れ替わる経過が書かれています。
タイトル”Establishment of self-renewable GM-CSF-dependent immature macrophages in vitro from murine bone marrow”
In adults, hematopoietic stem cells (HSCs) give rise to most macrophages and they are replaced continually by macrophage and DC precursors [4,5]. In adult mammals, HSCs also give rise to circulating monocytes. All resident macrophages in tissues may be derived from circulating monocytes [2]. However, this model of the development of the MPS has been challenged recently. In vertebrate embryos, two different types of hematopoietic cells can give rise to macrophages [6,7]. In mice, on embryonic day 8 (E8), the yolk sac (YS) gives rise to macrophages [8]. Then, definitive HSCs emerge from the mouse hematogenic endothelium of the aorto-gonadal-mesonephros region at E10.5 [9,10]. At later times, the fetal liver is the source of definitive hematopoiesis that generates circulating monocytes during embryogenesis. Coincident with the postnatal formation of bone, fetal liver hematopoiesis declines and is replaced by BM hematopoiesis.
コメント
Re: 最初の細胞
Zscan4さん、ご質問ありがとうございます。
>体のどこかに生き続けているんでしょうか? はたまた、平均寿命の百数十回と言われている細胞分裂のあと消えるのでしょうか?
こういう質問は、Lさんが最近の知見を教えてくれるでしょう。Lさんの専門は、血液学ですから。
Zscan4さんが聞けば、いろいろ教えてくれるでしょう。
成体にある細胞は、すべて受精卵由来ですが、分化増殖して臓器をつくり、かつ世代が入れ替わり続けます。
腸の細胞は2-5日で入れ替わります。
死滅した細胞は、アポトーシスによって、体内で処理され消失します。
しかし、そのような体細胞の増加とは異なり、卵子の元となる細胞などは、生下時の時の方が細胞数が多いです。
卵祖細胞についてウキペディアに説明があります。
https://ja.wikipedia.org/wiki/%E5%8D%B5%E7%A5%96%E7%B4%B0%E8%83%9E
成体に存在する細胞(例えば脳のグリア細胞)の中には、胎児期の細胞の機能を保持している細胞があります。
自己の状態を変化させずに、そのままの状態で複製する能力を保持しています。
つまり、母細胞と娘細胞が同じ状態で、世代は変わっても細胞として同じ状態を維持します。
成体脳のグリア細胞が胎生期に脳に生着した細胞であろうとの根拠のひとつとして、成体脳のグリア細胞が胎児細胞のみにみられる限定的表面蛋白を持つ事などがあげられています。
また、脳は他の臓器細胞が侵入できない構造体で閉鎖環境なので、胎児の分化が進むと、脳組織以外の細胞は脳内に入れません。
2021/01/16 URL
2021/01/16 URL