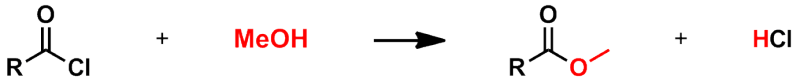---------------------------------
前回の記事
カルボン酸 → エステル ①
---------------------------------
前回は、触媒共存下における脱水縮合を用いて、
カルボン酸からエステルを合成する方法について述べた。
今回は、活性アシル中間体に変換後、
アルコールと反応させる二段階法について述べる。
-------------------------------------------------------------------------
① 触媒共存下における脱水縮合
② 活性アシル中間体に変換後、アルコールと反応させる二段階法
③ 縮合剤の共存化、カルボン酸とアルコールを反応させる一段階法
④ カルボキシラートアニオンとハロゲン化アルキルによるSN2反応
⑤ TMSジアゾメタンを用いたメチルエステル化
-------------------------------------------------------------------------
■カルボン酸塩化物
カルボン酸ハロゲン化物は、反応性の高い化合物群である。
中でも、カルボン酸塩化物は、有用な合成中間体として常用されている。
以下に示すように、カルボン酸塩化物は、同類縁体の中で最も高い反応性を示す。
したがって、酸塩化物は、酸無水物・エステル・アミドなどに、
容易に変換することが可能である。
酸塩化物 > 酸無水物 > エステル > アミド > ニトリル
酸塩化物への変換は、下記に示す試薬を用いて行う。
塩化チオニル、塩化オキサリル、三塩化リン、五塩化リン、塩化スルフリル …etc
本エントリーでは、特に使用頻度の高い塩化チオニル、塩化オキサリルについて述べる。
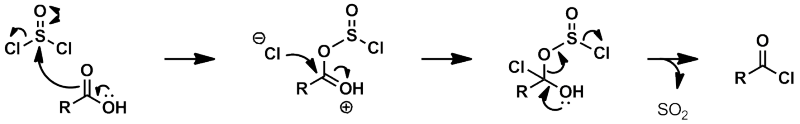
■塩化チオニル
塩化チオニルとカルボン酸の反応機構は、以下に示す通りである。
反応式に書き直すと、以下のようになる。
上式より、等量の二酸化硫黄、塩化水素が発生することが分かる。
二酸化硫黄は有毒な気体である。したがって、この反応にはドラフトが必須となる。
また、塩化水素が発生するので、系中は酸性条件となる。
酸に不安定な化合物には、本反応を用いることはできない。
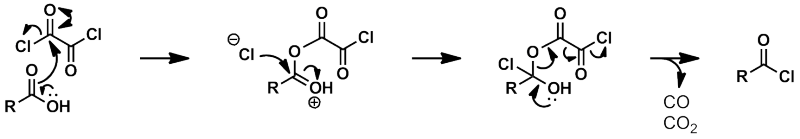
■塩化オキサリル
塩化オキサリルの反応も、塩化チオニルと類似の機構で進行する。
反応式に書き直すと、以下のようになる。
等量の一酸化炭素、二酸化炭素、塩化水素が生成することが分かる。
この反応もドラフトが必須であり、酸に不安定な基質はご法度である。
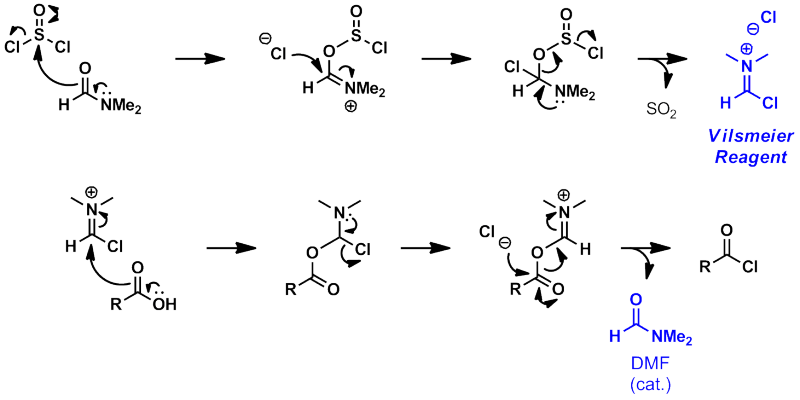
■DMFの効果
塩化チオニルや塩化オキサリルによる酸塩化物の合成では、
DMFが触媒として加えられることが多い。
以下に、それぞれの場合における反応機構を示す。
□塩化チオニル
□塩化オキサリル
反応機構を書いてみても明らかなように、Vilsmeier試薬が介在していることが分かる。
これが、高活性な求電子剤として、反応加速に寄与していると考えられる。
また、反応終了後に、DMFが再生していることも分かる。
したがって、DMFは触媒量で良い。
■酸塩化物の生成の確認
酸塩化物が、ちゃんとできているか。
これを確認することは重要である。
エステルやアミドに変換しようと反応を試みたが、
反応操作終了後、原料のカルボン酸がやたらと残っている。
こういった問題が起きた時、判断に困ってしまうからでる。
1. 酸塩化物がちゃんと出来ていなかったのか?
2. アルコールやアミンとの反応の際に加水分解が起きたのか?
問題の所在を判断するためには、酸塩化物の生成をチェックすれば良い。
酸塩化物は不安定なので、そのまま分析することは難しい。
したがって、エステルやアミドに変換したあと、
TLC や LC/MS などでチェックすると良い。
1. 系中から微量のサンプルをとる。
2. サンプルを少量のメタノール or 少量のアンモニア水にとかす(A)
3. A の TLC や LC/MS をチェックする
酸塩化物が綺麗に生成しているなら、
メチルエステル体や一級アミド体が、単一生成物として確認できるはずである。
ただし、後者の一級アミド体では、カルボン酸と分子量が1しか違わない。
MSで確認する場合は、注意が必要である。不安ならば、メチルアミンを用いれば良い。
■エステル、アミドの合成
酸塩化物を合成後、それをアルコールと反応させれば、エステル体が生成する。
アミンと反応させれば、アミド体が生成する。
これらはほとんどの場合、室温ですみやかに反応が進行する。
ただ、上記の反応式で示したように、系中はすでに酸性条件になっている。
下記の反応式を見ても明らかなように、置換が進むにつれて、さらに塩化水素が生成してくる。
したがって、系中の酸を中和する必要性が生じることになる。
ピリジンやトリエチルアミンといった「求核性の低い塩基」を添加すると良い。
うまくいかない場合は、ショッテン・バウマン反応などを検討する。
また、塩基の代わりにDMAPを加えることで、
アシルピリジニウム中間体を経由した置換反応を利用することもできる。
以下は、一般的な酸塩化物の合成例とその実験項である。
308.4 g (3.5 mol) of butyric acid is added to 175 ml of toluene and 4 ml of DMF. 281.3 ml (461.1 g, 3.9 mol) of thionyl chloride was added slowly to this mixture in 1.5-2 hours while stirring. The resulted mixture was slowly heated to 100-102 ℃, at 40-45 ℃ the mixture started "boiling" due to gas evolution, the time of heating from "boiling" to the end of the reaction ~ 9 h. The toluene solution of butyryl chloride was distilled at 101-105 ℃ at normal pressure, yielding 510.9 g of toluene solution, containing 343 g (92%) of butyryl chloride.
WO2011099010 / TotalPatent
To a solution of the carboxylic acid (10.0 mmol, 1.0 equiv) in dry CH2Cl2 (60 mL) at 0 ℃ under an atmosphere of N2 was added dropwise of SOCl2 (1.5 mL, 20.0 mmol, 2.0 equiv) followed by a catalytic amount of dry DMF (3 drops). The reaction was allowed to stir at room temperature until completion (typically 3 h). The solvent was then removed under reduce pressure. The corresponding crude acid chloride.
1. Add oxalyl chloride (27.5 mmol) and DMF (2 drops) to a solution of the corresponding benzoic acid (9.0 mmol) in CH2Cl2 (30 mL) at 0 ℃.
2. Stir the mixture at room temperature for 2.5 hours.
3. Concentrate the reaction mixture.
4. Use the crude product directly in the next reaction.
↓応援クリックしてくれると励みになります!