下記の記事をビヨンドヘルス様のホームページからお借りして紹介します。(コピー)です。
老化研究の世界でいま、注目を集めるキーワードがある。それは、「老化細胞」だ。老化細胞が老化を加速させ、様々な病気の発症に影響を与えていることが分かってきており、この細胞に着目した老化制御研究も盛り上がりをみせている。若い人の体にも存在する老化細胞とはどんな細胞で、どのような研究が進んでいるのか。この分野の研究の第一人者である大阪大学微生物病研究所遺伝子生物学分野の原英二教授に聞いた。

大阪大学微生物病研究所遺伝子生物学分野の原英二教授
老化細胞の蓄積による慢性炎症が老化を加速させる
普段意識することはないが、私たちの体には約37兆個の細胞があり、一部の細胞は、日々、分裂を繰り返している。
「その過程で、DNAが修復不可能なほど大きなダメージを受けたときに、細胞分裂を停止してがん化を防ぐ『細胞老化』と呼ばれる仕組みが備わっています。細胞老化は、自分の体の細胞をがん化させないために、人間を含む高等動物が進化の過程で獲得した安全装置の1つです」と原教授は説明する。
通常、古い細胞が分裂を停止して新しい細胞に置き換わるときには、自ら死んで壊れるアポトーシス(細胞死)を起こすか、免疫細胞に食べられて体内から消える。ところが、細胞老化によって分裂を停止した細胞の中には、なぜか死なずに、臓器や組織の中に残ってたまっていくものがあるのだという。
「この、細胞分裂を停止したのに死なずに組織にたまっていく細胞が『老化細胞』です。老化細胞は蓄積すると、SASP(サスプ:細胞老化随伴分泌現象/Senescence-Associated Secretory Phenotype)という現象を引き起こします。老化細胞の存在は60年くらい前から知られていたのですが、過度のSASPが慢性炎症を誘発し、がんや動脈硬化など加齢に伴って増える病気を発症させることが近年の研究で分かり、注目を集めるようになりました」と原教授は話す。
SASPは、周囲の正常な細胞の細胞老化を引き起こし、さらに老化を加速させる。米国の科学ジャーナリストは、英科学誌の『ネイチャー』のコラムで、分裂をしないが死にもしない奇妙なこの老化細胞を「ゾンビ細胞」と表現した。まるで死体が蘇るように、炎症を起こす物質を出して周囲の細胞の老化を加速させて仲間を増やし、組織や臓器の機能を低下させるゾンビのような細胞というわけだ。
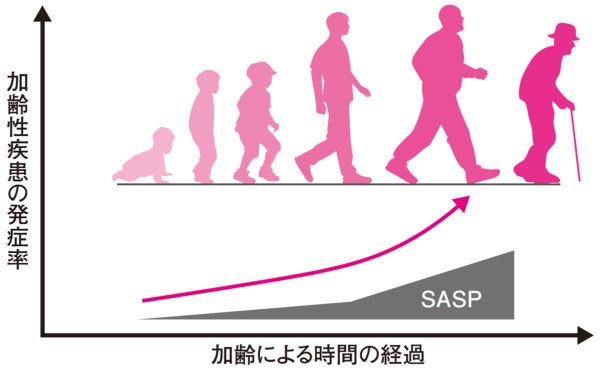
図1●年齢とSASP・加齢性疾患の発生率(イメージ)
加齢により老化細胞が増え過度のSASPが発生、加齢性疾患の発症率も上がる傾向がある(出所:「100年ライフのサイエンス」日経BP)
新型コロナの重症化も老化細胞の蓄積が要因に
老化細胞が蓄積することで過度なSASPが起こると、がん、心血管疾患、糖尿病、白内障、慢性閉そく性肺疾患、アルツハイマー型認知症、骨粗しょう症、変形性膝関節症など、加齢によって増える様々な病気につながることも分かっている。
最近では、新型コロナウイルスで高齢者や糖尿病などの基礎疾患がある人が重症化しやすいのは、老化細胞が蓄積し過度なSASPが起こっていることが一因である可能性が指摘された。ドイツのグループは、2021年9月、新型コロナウイルスをハムスターに感染させた研究から、細胞老化の誘導が新型コロナウイルス感染症の病態にも関係しているのではないかと報告している。ハムスターが新型コロナウイルスに感染すると、感染初期にSASPを起こした老化細胞が出現するが、セノリティクス(老化細胞を特異的に除去するとされる薬)で処理すると老化細胞が減少し、SASPによると思われる炎症反応も減弱したという(※1)。
ただし、老化細胞は単なる悪役ではなく、正の側面も持っていることも知っておきたい。「SASPには、免疫細胞を呼び込んで不要になった老化細胞を死滅させたり、周囲の細胞を活性化させて傷ついた組織の修復を促したりして体を守る働きもあります。老化細胞は若い人にも発生しており、若いときにはがんの抑制や傷の修復など体を守る働きのほうが強いと考えられます」と原教授は語る。
人間が自分の体の細胞を正常に保つ仕組みは我々が考えている以上に複雑だ。若いときには体を守っていたはずのSASPは、中高年になると老化をさらに加速させる悪役の面が強くなっていくというわけだ。
「人間の寿命が延びたのは、ここ120年くらいのこと。もっと長い年月をかけて延びたのであれば、ヒトは老化細胞やSASPによる副作用が出ないように進化したのかもしれません。急速な寿命の延びに人間の進化が追い付かず、平均寿命が50歳くらいだったときには目立たなかった老化細胞の負の側面が表面化したのではないかと考えています。同じ年齢の人でも、老化細胞のたまり方には個人差があります。この老化細胞をどうコントロールしていくか、それが老化制御の大きな研究テーマです」
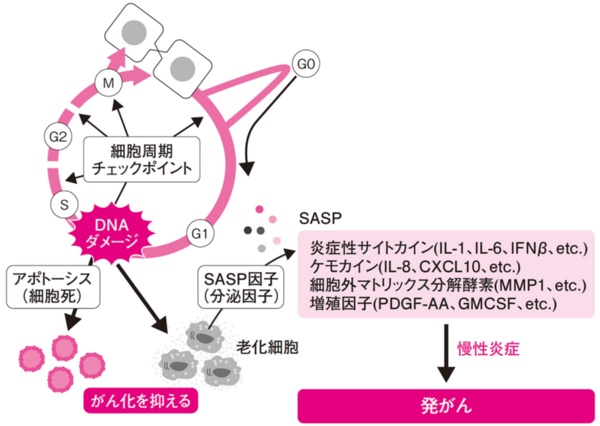
図2●老化細胞の誘発とSASPの発生
細胞分裂の過程で細胞周期チェックポイントがDNAダメージを感知すると、細胞老化が進み、組織の中に老化細胞として残ることがある。これがSASPを誘発、慢性炎症を引き起こし発がんの原因になることがある(出所:「100年ライフのサイエンス」日経BP)
腸内細菌叢に悪玉物質が増えると老化細胞が蓄積
老化細胞に着目した老化制御としてまず注目されるのが、老化細胞がたまることを防ぐための研究とその成果だ。
老化細胞がたまらないようにするにはどうしたらよいのだろうか。原教授が第一に勧めるのは、肥満を防ぐことだ。原研究室では、マウスを用いた研究で、高脂肪食を食べ過ぎて肥満になると、腸内細菌が変化して悪玉物質が産出され、それが肝臓に運ばれることによって老化細胞がたまって過度のSASPが発生し、肝臓がんが発症するリスクが高まることを解明した。そして、さらに怖いのは、高脂肪食で飼育されたマウスの約3割は、肝臓がんだけではなく肺がんも併発していたことだ。
また、肥満や脂質異常症などで、脂肪が肝臓に蓄積する脂肪肝から非アルコール性脂肪性肝炎(NASH)になり、肝臓がんを発症した患者の腫瘍を調べたところ、約3割の患者の肝星細胞が細胞老化とSASPを起こしていた。一般的に、NASHから肝臓がんになる場合は肝硬変を経て発症するが、老化細胞が蓄積していた患者の中には、肝硬変を経ずにいきなりがんを発症していた患者もいたという(※2)。
「私たちの体の中には、30兆から100兆個の腸内細菌が存在しており、その構成は食事の内容や栄養状態によって変化します。高脂肪食や過食が続くと、腸内細菌叢が変化して悪玉物質が増加し、肝臓がん以外にも大腸がんの発症の引き金になる可能性があるので要注意です(※3)」と原教授。さらに、高脂肪食によって腸内細菌叢に悪玉菌が増えると、がん以外にも、うつ病、認知症、糖尿病などにつながる恐れもある。
ただ、定期的に適度な運動を続ければ、老化細胞の蓄積を抑えられる可能性もある。中年マウスを高脂肪食で飼育すると脂肪組織に老化細胞が蓄積してインスリンの分泌が低下し血糖値が上がりやすくなるが、有酸素運動をさせると老化細胞がたまりにくくなり、糖尿病リスクも改善するという(※4)。ウォーキング、ジョギング、水泳などの有酸素運動は生活習慣病を防ぎ健康維持に役立つばかりか、老化細胞の蓄積を防ぐことにもつながるわけだ。
もう一つ、老化細胞の蓄積を防ぐために原教授が重視するのは、DNAを傷つけないようにする「体に優しい生活」だ。「喫煙、PM2.5(微小粒子状物質)、過度の紫外線、過度の飲酒は、修復不可能なDNAダメージを引き起こし、老化細胞を蓄積させ、発がんを誘発します。家族や同僚などの喫煙による受動喫煙も含めて、DNAダメージの要因になることはできるだけ避けましょう」と原教授は強調する。
老化細胞を除去する薬の開発も進行中
一方、老化細胞を除去する薬(セノリティクス/老化細胞除去薬)により、過度のSASPによって発症する加齢性疾患を減らし、寿命を延ばす研究も進められ、期待が高まっている。
セノリティクスが、世界的な注目を集めるきっかけとなったのは、特定の薬を投与すると老化細胞を除去できるように遺伝子改変されたマウスの研究だった。遺伝子改変された高齢マウスに、週2回、老化細胞除去を引き起こす薬を投与した研究では、脂肪、腎臓、心臓などの組織から老化細胞がなくなり、毛並みもふさふさして見た目が若返って元気に動き回るようになって、健康寿命も延びた(※5、6)。米国では、この研究の結果が報告された2011年以降、老化制御ビジネスを進めるベンチャー企業が次々と設立された。その代表格が、同研究を進めていたメイヨークリニックのヤン・ファン・ドゥールセン博士らが設立し、米アマゾン創業者のジェフ・ベゾフ氏が投資したことでも知られる米ユニティ・バイオテクノロジーだ。
日本では、原教授の研究グループが、約4万7000の化合物を調べた結果、ARV825というがんの増殖阻害剤をベースにした化合物が有望な老化細胞除去薬候補に選ばれた。肥満が原因で肝臓がんになりやすいマウスにARV825を注射すると、細胞内の不要な物質を除去するオートファジー経路が活性化され、肝臓にたまった老化細胞が除去された。その結果、肝臓がんの発症が抑えられたという。ヒトの大腸がん細胞を用いた実験でも、ARV825が老化細胞を除去する効果が確認されている(※7)。
とはいえ原教授は、「セノリティクスの社会実装には、越さなければならいハードルが多数あり、ここ1~2年で実用化されるというような段階ではありません。最も実用化が近そうだったのがユニティ・バイオテクノロジーの変形性膝関節症に対する老化細胞除去薬ですが、その開発のために行われていた治験は、当初期待された結果が出なかったために中止されました。また、仮に老化細胞の除去に成功したとして、正常な細胞まで攻撃したり、SASPの良い面が失われたりする弊害はないのかなどのエビデンスも必要で、研究は慎重に進めていかなければなりません」と指摘する。
セノリティクスは“老化制御の切り札“との見方もあり、開発は世界中で進められている。医療界のみならず、ビジネス界からの期待が高い研究・開発テーマだからこそ、冷静な目でウオッチすることが大切なようだ。
※1 Nature. 2021 Nov;599(7884):283-289.
※2 Nature.2013 Jul 4,499(7456):97-101.
※3 Nat Commun.2021 Sep 28;12(1):5674
※4 Diabetes.2016 Jun,65(6):1606-15.
※5 Nature. 2011 Nov 2;479(7372):232-6.
※6 Nature. 2016 Feb 11;530(7589):184-9.
※7 Nat Commun.2020 Apr 22;11(1):1935.
原 英二(はら・えいじ)氏
大阪大学微生物病研究所遺伝子生物学分野教授
 長崎県出身。1993年、東京理科大学大学院博士課程修了。英国のPaterson Institute for Cancer Research, Christie Hospitalのラボヘッド、徳島大学ゲノム機能研究センター教授などを経て、2008年、公益財団法人がん研究会 がん研究所・部長。2015年より現職、同大免疫学フロンティア研究センター老化生物学教授兼任。細胞老化を誘導するメカニズムの解明とその制御法の確立を目指す。
長崎県出身。1993年、東京理科大学大学院博士課程修了。英国のPaterson Institute for Cancer Research, Christie Hospitalのラボヘッド、徳島大学ゲノム機能研究センター教授などを経て、2008年、公益財団法人がん研究会 がん研究所・部長。2015年より現職、同大免疫学フロンティア研究センター老化生物学教授兼任。細胞老化を誘導するメカニズムの解明とその制御法の確立を目指す。
