これは、生物基礎で必要な化学の基本知識
化学の勉強をしていない高校1年生に向けた内容です。
(ちょっと詳しく勉強したい中学生向けですね)
どこへも出かけないGWを利用して、書いてます。
面倒な方はスルーしてくださいね~!(笑)
前回の宿題
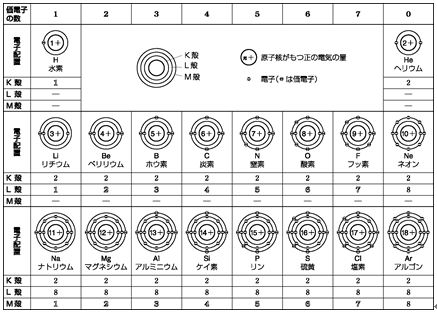
K(カリウム)とCa(カルシウム)の電子配置図です。
M殻には18個まで電子が入りますが、M殻に8個入ると、
次はN殻に2個入り、その後M殻の空席を埋めていきます。
19番のカリウムはNaの下で、H、Li、と同じ1族に並びます。
1族の原子は、すべて一番外側(最外殻)の電子が1個。
これが不安定な状態の原因になるのです。
では、どうしたら安定な姿になれるでしょう?
希ガスの電子配置=安定した状態
(=スーパーモデル)でしたよね。
不安定な原子は、
「そうだ!スーパーモデルになろう!」
そうです。みんなスーパーモデルを目指します。
例えば、ナトリウム(Na)君は、最外殻の電子を誰かさんに渡します。
すると、電子の数は10個となり、
スーパーモデル ネオン(Ne)君と同じ姿になれるのです。
外観(電子の数は10個)は同じようになれたものの、
原子核の中の陽子の数は異なります。
ナトリウムは11個、ネオンは10個
ナトリウムイオンは
原子核内の陽子数 11 > 電子数 10
となり、「+」の電気の方が1つ多い状態になる。
ですから、+の電気を帯びた粒(=陽イオン)になります。
イオン式は「Na+」 と表します。
では、塩素(Cl)君はどうしたらスーパーモデルになれますか?
誰かさんから電子を一つもらえば、スーパーモデルのアルゴン(Ar)君と同じ姿(電子配置)になれる!
塩素が電子を一つもらうと、
原子核内の陽子数 17> 電子数 18 となり、
「-」の電気の方が1つ多い状態。
ですから、-の電気を帯びた粒(=陰イオン)になります。
イオン式は「Cl-」 と表します。
こんな風に、電子をもらったりあげたりしながら変身することで、
不安定な状態から安定した状態を作るのがイオンです。
【練習】 マグネシウムイオンはどのようにできますか?
もうわかりますよね。
12番のマグネシウム君は、最外殻に2つの電子を持っています。
この2つを誰かさんに渡して、10番のネオン君と同じ姿になるよ。
マグネシウムは電子を2つ放出するので、
陽子数 12 > 電子数 10 となり、陽子(+)が2つ多い状態に!
だから、Mgの右肩に 「2+」と書いて、イオン式とします。
さて、電子を誰かさんからもらったり、誰かさんに渡したり、、、
誰に?
例えば、ナトリウム君と塩素君がいれば、
ナトリウム君の電子を塩素君が受け取ります。
ちゃんと受け渡しできる相手が必要なのです。
相手がいなければ、不安定なまま我慢するしかない。
でも、地球上にはたくさんの原子があるので、
すぐに誰かさんと受け渡しができる環境のようです。
イオンは「+」の電気と「-」の電気を持った粒なので、
陽イオンと陰イオンは、電気的に引っ張り合って結合する。
静電気的な力 = クーロン力 によって。
これが「イオン結合」ですね~。
Na+ と Cl- の場合は、
それぞれの力の強さが同じなので、1:1でつりあう。
Na+ + Cl- → NaCl (塩化ナトリウム)
↑
イオン結合でできた物質を示す式を 組成式
+のイオンを左に、-のイオンを右側に書き、
電気は打ち消しあうので+やーはつけない。
読み方は、後ろの陰イオンを先に。
Mg2+ と Cl- の場合は、
「+」が2、「-」が1なので、
力がつりあうためには、「-」が2つ必要。
だから、Mg2+ + 2Cl- → MgCl2
(塩化マグネシウム)
組成式を書く時に、1:2の割合を示します。
1の場合は「1」を書きませんが、
2以上の場合は、右下に小さく2、3を書く。
ここで注意が必要なのは、1:1とか1:2という比で表してありますが、+イオンとーイオンが1個ずつ、または1個と2個が結びつく訳ではありません。
たくさんのイオンが集まって、その集団の中に1:1とか1:2の割合でイオンが含まれていると考えましょう。
1個と1個が結合して1つの粒を作っていたら、
それを「分子」と呼びます。
だから、イオン結合でできた物質は 「分子」を作りません。
イオン結合をした物質は、水に溶けて陽イオンと陰イオンに分かれる(=電離する)ものが多い。
塩化ナトリウム水溶液(食塩水)の中では、
Naは電子を放出して ナトリウムイオン(Na+)に、 Clは電子を受け取って 塩化物イオン(Cl—)になって泳ぎ回っている。
陽イオンと陰イオンのように、電気を持ったものが動き回ることで電気が流れる = 電気を通すことができる = 電解質
では、だんだん水を少なくしていくと、
泳げなくなってきますよね~。
すると、
プラスとマイナスのイオンがきれいに整列して結晶になります。
こうなると、イオンは動き回ることができないので、
電気を通さなくなります。
イオン結合でできた物質は、
・分子を作らない
・陽イオンと陰イオンが一定の割合で集合体をつくる
・結晶は電気を通さない
・液体になったり、水に溶けると電気を通す
おさらいです。
もう一度20番までの周期表を確認してみましょう!
周期表の縦の列は、イオンになる時に、
同じふるまいをする元素たちです。
C や Si は、電子を4個捨てるか4個受け取らないと
希ガスと同じ電子配置になれません。
どちらもなかなか難しいので、イオンにはなりにくいです。
また、NやPも電子を3個受け取らないといけませんが、
これもちょっと難しいのでイオンになりにくいです。
そういう原子はイオンにならずに別の方法で安定した姿を目指します!
という訳で、イオンについて理解できたでしょうか?
次回は「分子を作る物質」について学びましょう!