アンモニアを燃やしてエネルギー源にするのは窒化斑ができるので賢い選択とはいえない。
それにいままでのアンモニアを製造するには水素が必要だった。
水素があるのに水素からアンモニアをつくる(ボッシュ法)のは本末転倒だ。
ところが
水からアンモニアを触媒をとおしてアンモニアをつくれるというヒトがでてきた
。
一部転載:
このような中、CRESTの研究代表者である西林仁昭教授は、世界で初めて、アンモニアを窒素ガスと水から常温・常圧で簡単かつ大量、しかも、高速に合成する画期的な方法を開発した。この研究成果は2019年4月の「Nature」誌(オンライン速報版)で公開され世界から注目されている。
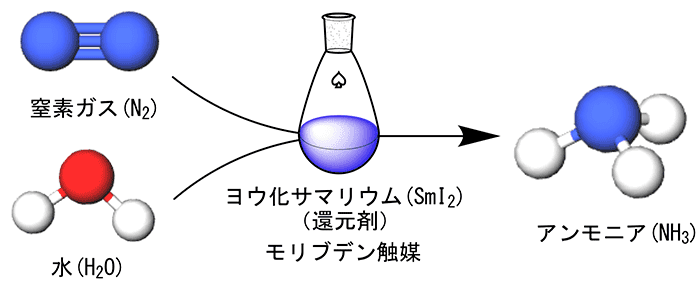
図1 アンモニアを窒素ガスと水から常温・常圧で簡単かつ大量、しかも高速に合成する画期的な方法を開発
マメ科植物に共生する「根粒菌」をヒントに画期的な合成法を創出
ハーバー・ボッシュ法では、アンモニアの原料となる水素の製造に化石燃料が使われている。一方、自然界には、常温・常圧で空気中の窒素からアンモニアを合成する酵素が存在することが知られている。それはマメ科植物に共生する「根粒菌」という細菌がもつ「ニトロゲナーゼ」である。ニトロゲナーゼは、窒素からアンモニアを合成する際、ニトロゲナーゼ分子の中に存在するモリブデン(Mo)原子を使っている。西林教授はこのニトロゲナーゼに注目した。そして、モリブデンを含む触媒を用い、窒素ガスと水、そして、ヨウ化サマリウム(Sml2)を用いることで、常温・常圧、かつニトロゲナーゼに匹敵する速さでアンモニアを合成することに成功した。
具体的なプロセスは、まず、モリブデンを含む触媒に窒素分子(N2)が結合する。そこに、もう1つの触媒が近づき、窒素分子の窒素原子(N)同士の結合を切断する。その結果、モリブデンを含む触媒には窒素原子(N)が結合することになる。そこに、ヨウ化サマリウムが近づく。ヨウ化サマリウムは、水分子(H2O)から、アンモニア分子(NH3)の材料となる水素(H)を作る還元剤の役割をもっている。そのヨウ化サマリウムによって作られた3つの水素原子が窒素原子と結合し、アンモニアができる。できたアンモニアは触媒から分離され、触媒は元の状態に戻る。この反応が繰り返されることで、大量にアンモニアが合成される。
しかし、
サマリウム(Sm)は希土類(レアアース)の1つで、比較的安価だが、実用化に際しては再利用する必要がある。西林教授の研究グループでは、実用化に向け、企業と共同でヨウ化サマリウムの回収・再利用サイクルの工業化に取り組んでいく計画だ。
ヨウ化サマリウムまだ再利用できない。