電池はわかってしまえば覚えればよいが
実はそこにたどりつくまでは多くのアイデアと工夫が凝らされている。
希硫酸をつかった電池には
ボルタ電池
鉛電池
がありその歴史とメカニズムを学ぶことは猪木がある。
1)
|
Zn板:Znが〔 電子 〕を放出して〔 Zn2+ 〕になる
〔 Zn → Zn2+ + 2e- 〕
Cu板:極板上に流れてきた電子を電解質の〔 陽イオン 〕が受け
取る。この場合は,〔 H+ 〕が受け取り〔 H2 〕とな
る。
〔 2H+ + 2e- → H2 〕 |
|
|
この電池はボルタ電池といわれている
2)
|
ダニエル電池
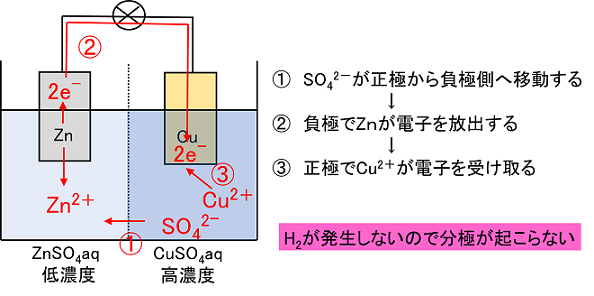
電池式〔 (-)Zn|ZnSO4aq|CuSO4aq|Cu(+) 〕 亜鉛板を〔 低 〕濃度の硫酸亜鉛水溶液に浸したものと,銅板を〔 高 〕濃度の硫酸銅(Ⅱ)水溶液に浸したものをセロハンや素焼きの素材で仕切り,亜鉛板と銅板を導線でつないだ構造の電池をダニエル電池という。この構造は,ボルタ電池のような正極上での水素の発生がおこらないようになっている。 |
3)
鉛蓄電池
電池式〔 (-)Pb|H2SO4aq|PbO2(+) 〕
負極に〔 鉛 〕,正極に〔 酸化鉛(Ⅳ) 〕を用い,〔 希硫酸 〕に浸した電池を〔 鉛蓄電池 〕といい,車のバッテリーに使われている。
正極の酸化鉛(Ⅳ)は金属に近い電気伝導率があるため電極として用いることができる。また,負極と正極のPbの酸化数の差(負極0,正極+4)が大きいことを利用した電池である。
この電池は放電したのち,外部電源によって,放電と逆向きに電流を流すと逆反応がおこり,もとの状態に戻すことができる。この操作を〔 充電 〕という。充電によってくり返し使うことができる電池を〔 二次電池 〕または〔 蓄電池 〕といい,充電による再利用ができない電池を〔 一次電池 〕という。
負極〔 Pb + SO42- → PbSO4 + 2e- 〕
この反応は次のような流れで考えるとよい。
① PbがPb2+になり,e-を放出 Pb → Pb2+ + 2e-
② 生成したPb2+は溶液中のSO42-と不溶性のPbSO4をつくる。これは,Pb2+の特徴で,PbSO4は電極に付着する。
Pb2+ + SO42- → PbSO4
①と②の反応式を合わせると,負極の反応になる。
正極〔 PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O 〕
この反応は次のような流れで考えるとよい。
① 正極に流れてきたe-をH+が受け取りH2となる。 2H+ + 2e- → H2
② 生成したH2は電極であるPbO2により酸化されH2Oに,PbO2はPbになる。(電極自身が酸化剤になって発生するH2を酸 化するしくみになっている) 2H2 + PbO2 → Pb + 2H2O
③ 生成したPbは,負極と同様にSO42-と反応して不溶性のPbSO4となり電極に付着する。
Pb + SO42- → PbSO4 + 2e-
①~③の反応式を,左右にある同じもの(e-以外)が消えるように合わせる(①×2+②+③)と,正極の反応になる。
|
|
|
|