本記事はこちら↓ 【PRTIMES 様】
注目の研究です。患者数が多かったり、悪性度が高いこともある、乳がん、結腸がん、卵巣がん、頭頸部がん、膵臓がん、腎臓がん、胃がん、子宮頸がんに関して、悪性に関わる分子「VGLL3」が特定されました。新薬が創薬され、大幅な治療成績向上に期待しています。
【抜粋】
千葉大学大学院医学薬学府 堀 直人 博士課程大学院生、薬学研究院 高野 博之 教授、山口 憲孝 准教授のグループは、がんの悪性化を促進する新しい鍵分子である、遺伝子発現調節因子Vestigial-like family member 3(VGLL3)を発見しました。この成果により、VGLL3を阻害する作用をもつ、新しいがん治療薬開発が可能になると期待されます。
●研究の背景
がんの悪性化の原因として、上皮間葉転換(Epithelial-mesenchymal-transition:EMT)が知られています。EMTは、細胞間接着の強い上皮系がん細胞が、細胞間接着が弱く運動性が高い間葉系がん細胞の形質を獲得する現象です。EMTが生じることで、がん細胞は高い運動性を獲得し、多臓器への浸潤・転移が引き起こされます。そのため、がん細胞のEMTのメカニズムを解明することは、がんの新しい治療薬開発に重要です。
●研究成果
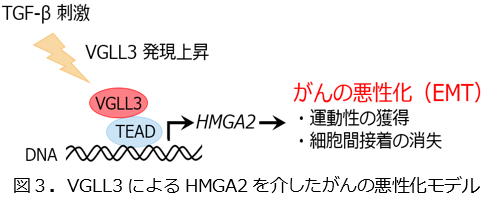
EMTを誘導する原因として、サイトカイン(細胞から分泌されるタンパク質)の1つであるTransforming growth factor β(TGF-β)があります。研究グループは、EMT誘導メカニズムを解明するため、遺伝子発現データベースの解析を駆使してTGF-β刺激によって細胞内発現量の増加する因子を探索し、VGLL3を見出しました。
次にVGLL3のEMTへの影響を解析するため、低悪性度のヒト上皮系がん細胞株を用いて、VGLL3を恒常的に発現する細胞(安定発現株)を作製しました。作製した細胞の形態を確認したところ、細長く伸び、重なるように増殖する間葉系がん細胞の形態を示すことがわかりました。
そこで、VGLL3安定発現株の細胞間接着と細胞の運動性について解析したところ、細胞接着タンパク質E-cadherinの発現量が著しく減少し、細胞の運動性が上昇していることが判明しました。
これらのことから、VGLL3安定発現株は間葉系がん細胞と合致する特性をもつことがわかりました。
さらに、VGLL3安定発現株について細胞全体の遺伝子発現解析を行い、VGLL3によるEMT誘導メカニズムについて解析を行いました。
その結果、VGLL3は、遺伝子発現調節タンパク質High mobility group AT-hook 2(HMGA2)の発現誘導を介して細胞間接着の低下や運動性の増進を導くことがわかりました。
このことから、VGLL3によるHMGA2を介した細胞間接着の低下や運動性の増進は、TGF-β刺激によるEMTにも重要であることが明らかになりました。
次に、実際のがんの悪性化におけるVGLL3によるHMGA2を介したEMT誘導の重要性について解析しました。まず、様々なヒトがん細胞におけるVGLL3の発現量について遺伝子発現データベースを用いて解析したところ、VGLL3は高悪性度の間葉系がん細胞において高く発現することがわかりました。
そこで細胞内で特定の遺伝子の発現を抑制する作用をもつRNAであるsiRNAを用いて、間葉系がん細胞におけるVGLL3の発現を抑制したところ、HMGA2発現量が減少し、細胞間接着の回復や運動性の低下が認められました。
さらに、VGLL3の発現とがん患者の予後との関連性について、がん患者における遺伝子発現と予後のデータベースを用いて解析を行ったところ、乳がん、結腸がん、卵巣がん、頭頸部がん、膵臓がん、腎臓がん、胃がん、子宮頸がんなどの様々ながんにおいてVGLL3を高く発現するがん患者の予後が悪いことが判明しました。これらのがん組織において、VGLL3が増加するとHMGA2の発現も増加することがわかりました。
以上の結果から、VGLL3はHMGA2の発現を介してEMTを誘導し、がん悪性化を促進する鍵分子であることが明らかとなりました。
●今後の展望
本研究から、VGLL3はHMGA2の誘導を介してEMTを導く鍵分子であり、実際に悪性化がん細胞において高く発現し、がんの進行を促進していると考えられます。今後、VGLL3の機能を阻害する作用を持つがんの新しい治療薬開発が可能になると期待されます。