1.一般医療機器(クラスⅠ)
『この法律で「一般医療機器」とは、高度管理医療機器及び管理医療機器以外の医療機器であつて、副作用又は機能の障害が生じた場合においても、人の生命及び健康に影響を与えるおそれがほとんどないものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。』(薬機法第2条第7項)
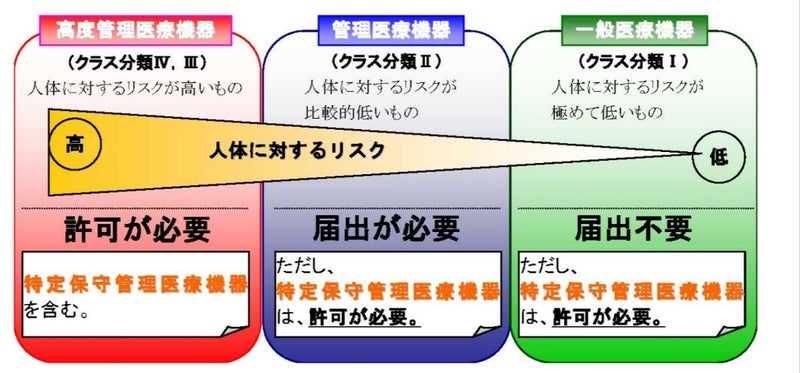
一般医療機器はクラスⅠに分類され承認は必要としませんが、厚生労働省に対する届出が必要です。
また、厚生労働省が指定する一般医療機器は、製造工程で滅菌工程の入る医療機器を除き、QMS適合性調査の必要がありません。
*申請者は第3種医療機器製造販売業許可を取得している必要があります。
*一般医療機器の製造業者は医療機器製造業許可(外国の製造業者は、外国製造業者認定)が必要です。
2.管理医療機器(クラスⅡ)
『この法律で「管理医療機器」とは、高度管理医療機器以外の医療機器であつて、副作用又は機能の障害が生じた場合において人の生命及び健康に影響を与えるおそれがあることからその適切な管理が必要なものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。』(薬機法第2条第6項)
管理医療機器はクラスⅡに分類され、薬事法第23条の2第一項の規定による基準が定められた管理医療機器(指定管理医療機器という)は、第三者登録認証機関による認証を必要としますが、それ以外の管理医療機器は厚生労働省による承認が必要です。
2019年5月時点で、2,274品目の認証基準が定められています。これらの認証基準に適合する場合には、第三者登録認証機関における認証申請の対象となります。
ただし、医療機器の形状、原理、使用方法及び操作方法若しくは性能が既存の医療機器と明らかに異なる場合は、認証基準は適用されず、承認申請の対象となります。
また、第三者登録認証機関に対して、認証申請と併せてQMS適合性調査申請も行い、医療機器製造所(製品の組立製造にかかるすべての製造所(外国製造業者を含む。)のQMS適合性調査についても第三者登録認証機関による監査を受けて、適合しなければ認証を取得することは出来ません。
*申請者は第2種医療機器製造販売業許可を取得している必要があります。
*管理医療機器の製造業者は医療機器製造業許可(外国の製造者は、外国製造業者認定)が必要です。
*製造業者に対してのQMS適合性調査は、PMDA、第三者認証機関、都道府県等によって行われます。
3.高度管理医療機器(クラスⅢ、Ⅳ)
『この法律で「高度管理医療機器」とは、医療機器であつて、副作用又は機能の障害が生じた場合(適正な使用目的に従い適正に使用された場合に限る。次項及び第7項において同じ。)において人の生命及び健康に重大な影響を与えるおそれがあることからその適切な管理が必要なものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。』(薬機法第2条第5項)
高度管理医療機器はリスクに応じてクラスⅢ及びⅣに分類され、厚生労働省による承認が必要です。ただし、平成26年11月に施行された医薬品医療機器等法においては、高度管理医療機器のうち「認証基準」が定められた医療機器等についても、この基準に適合する医療機器等については、その製造販売に当たって、登録認証機関の認証を受けなければならないこととされています。
*申請者は第1種医療機器製造販売業許可を取得している必要があります。
*高度管理医療機器の製造業者は医療機器製造業許可(外国の製造者は、外国製造業者認定)が必要です。
*製造業者に対してQMS適合性調査は、PMDA、 第三者認証機関、都道府県等によって行われます。
■高度管理医療機器販売業者・貸与業者の遵守事項
①管理者の設置
②許可証の掲示
(6年更新)
③変更届、休止・廃止などの届出
(管理者の氏名、住所変更などの含む)
④苦情処理・回収処理・不具合報告など
(適正使用に必要な情報の収集・提供)
⑤管理帳簿を備え、保存
(6年間保存)
⑥管理者の意見を尊重すること
⑦管理者の継続的な研修
(1年に1回受講する)