PA tag
PA tagはヒトポドプラニンのPLAG配列を利用したペプチドタグ(GVAMPGAEDDVV)による日本発のアフィニティータグシステムです。 抗PA tag抗体(NZ-1)はPA tagに対して高い親和性と特異性を持ち、PA tag融合タンパク質を高純度かつワンステップで精製可能です。ウェスタンブロッティングやフローサイトメトリー、免疫細胞染色にも応用することもできます。
また抗PA tag抗体はPA tagのループ構造を認識でき、膜タンパク質の精製・検出にも適用可能です。
PA tag 基本情報
| タグ配列 | GVAMPGAEDDVV |
|---|---|
| 由来 | ヒトポドプラニンPLAG配列 |
| 残基数(aa) | 12 |
| 分子量(kDa) | 1.16 |
| 等電点(pI) | 3.49 |
| 抗体結合力(KD(M)) | 4.9 x 10-10 |
| 抗体 | モノクローナル抗体 |
| 免疫動物 | ラット |
| クローンNo. | NZ-1 |
特長
PA tagと抗PA tag抗体の高い親和性と特異性
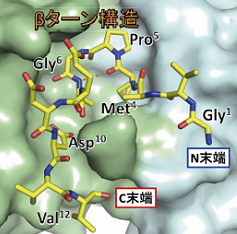
複合体の構造
PA tagと抗PA tag抗体の結合は、他のアフィニティータグと比べて10 - 100倍も強いことが分かっています。理由として ①タグと抗体が結合するときに立体構造がほとんど変化しないこと、② PA tagはβターン構造をとり、その構造が抗体の認識部位にしっかりとはまりこんでいることが挙げられます。
タグと抗体の親和性(結合の強さ)を比較した実験において、PA tagはタグと抗体がほとんど解離しないことが分かっています。タグと抗体の結合力を示す解離平衡定数(KD値)は小さければ小さいほど、結合力が強いことを意味しますが、PA tagは4.9 x 10-10Mで他のアフィニティータグと比較してもかなり高いことが分かります。
タグと抗体の結合が強ければ、標的タンパク質を抗体でしっかりと捕捉することが可能で、より強い洗浄操作も行うことができます。このような強い結合を有するにも関わらず、ペプチド添加による競合溶出が可能であることはPA tagの興味深い特長の一つです。
中性条件でレジンの再生が可能
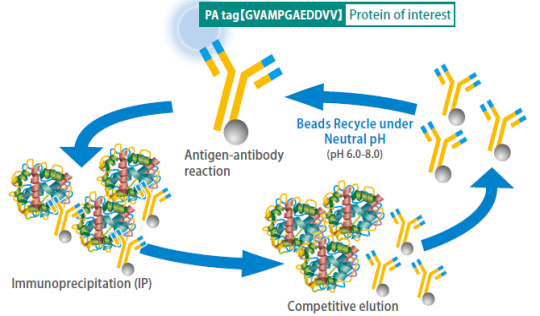
通常、抗体結合ビーズの再生には酸性バッファー(pH2.5〜3.5)が用いられますが、酸性バッファーは抗体にダメージを与えるため、再生の繰り返しによりタンパク質精製効率が低下します。
しかし抗PA tag抗体結合ビーズは専用の洗浄溶液を使用すれば、中性条件下で60回再生でき、タンパク質精製効率も低下しません。これによりタンパク質精製にかかるコストを抑えることができます。
- 洗浄溶液で完全に抗体からタグペプチドを除去できない場合もありますので、異なるタンパク質を精製する場合にはコンタミネーションにご注意してください。
ループ構造の認識が可能
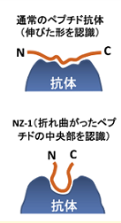
PAペプチドの認識機構
既存の抗タグ抗体はペプチドタグの伸びた形を認識します。したがって多くのペプチドタグはタンパク質のフレキシブルな領域(N末端、C末端)にしか付加できません。
しかしPA tagはPro-Glyの間でβターン構造をとり、抗PA tag抗体はこのβターン構造を認識します。この性質によりPA tagを標的タンパク質内部のループ構造に挿入して使用することが可能です。
これまでにPA tagは下記のような実験に使用された実績があります。
- 「インテグリン」のループ構造にPA tagを挿入し、免疫沈降を実施。
- 機能部位や活性部位と隣接するため、末端へのタグ付加ができない「セマフォリン3A」のループ構造にPA tagを挿入し、活性をもったタンパク質の調製に成功。
アプリケーションデータ
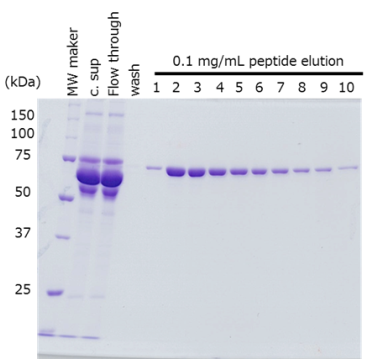
培養上清からのタンパク質精製
細胞培養上清においてPA tagをN末端、C末端それぞれに融合させたタンパク質を抗PA tag抗体ビーズを用いて精製しました。
-
PA tag N末融合タンパク質
-
PA tag C末融合タンパク質
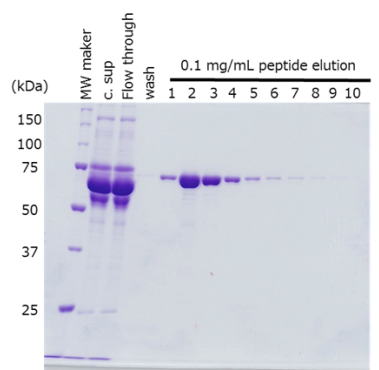
-
サンプル HEK293T 培養上清 420 mL
(トランスフェクション後48 - 72時間)抗体 抗PA tag抗体ビーズ (Net 4 mL) 反応条件 2時間, 2 - 4 ℃ 洗浄条件 抗体ビーズの4倍量のTBS(20 mM Tris-HCl、150 mM NaCl)で5回洗浄 溶出条件 抗体ビーズと等量のPA tagペプチド(0.1 mg/mL)を10回添加
PA tagの挿入位置に関わらず、目的タンパク質を高純度かつ効率的に精製できました。
データ提供:
大阪大学 蛋白質研究所附属蛋白質解析先端研究センター 分子創製学研究室 高木淳一 先生、東北大学大学院医学系研究科 地域イノベーション分野 藤井 勇樹 先生
ウェスタンブロッティング
DYKDDDDK tagとPA tagをC末端側に融合させたIDH1を発現する骨肉種細胞のライセートをサンプルにウェスタンブロッティングを行いました。
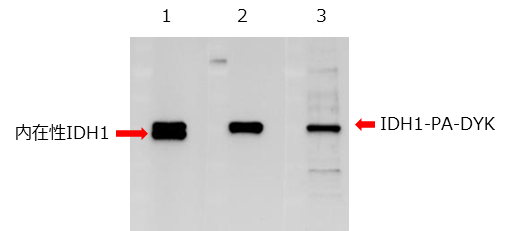 |
|
抗PA tag抗体は抗DYKDDDDK tag抗体よりも特異的にタグ融合タンパク質を認識していました。
データ提供: 東北大学大学院医学系研究科 地域イノベーション分野 加藤幸成 先生、金子美華 先生
膜タンパク質インテグリンの検出
膜タンパク質であるインテグリンのループ構造8か所にそれぞれPA tagを挿入し、抗PA tag抗体で免疫沈降をしました。
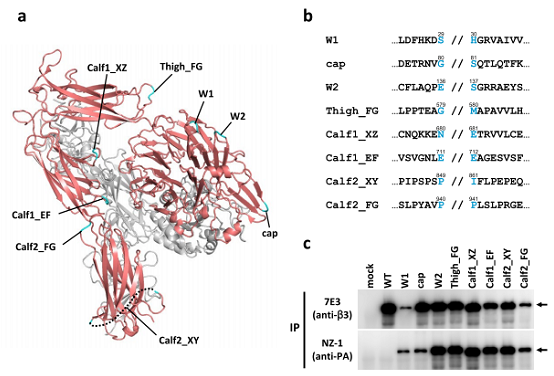
インテグリンのループ領域へのPAタグの挿入
(a) インテグリンαIIb(赤) β3(灰色)の細胞外領域の立体構造(PDB ID : 3FCS)。PAタグを挿入したループ領域をシアンで示す。
(b) 挿入部位付近のアミノ酸配列。12残基のPAタグは // の位置に挿入した。
(c) 各PAタグ挿入変異体の、抗インテグリン抗体(7E3、上段)および抗PAタグ抗体(NZ-1、下段)による免疫沈降の結果。
挿入したPA tagにより、ネイティブなインテグリンを沈降できました。

