悪性中皮腫に対する新しいα線標的アイソトープ治療薬候補を開発 ―既存の治療法では効果がない悪性中皮腫に新たな治療法として期待―
- 中皮腫1)細胞に結合してα線2)を放出する標的アイソトープ治療3)薬候補アクチニウム225(225Ac)標識抗ポドプラニン抗体4)を、中皮腫モデルマウスに投与して、がんサイズの縮小効果と生存期間延長を確認しました。
- 既存の治療法では効果がない悪性中皮腫に対する新たな治療法となることが期待されます。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門量子医科学研究所分子イメージング診断治療研究部の須藤仁美主任研究員、辻厚至グループリーダー、東達也部長は、国立大学法人東北大学大学院医学系研究科の加藤幸成教授、金子美華准教授と共同で、悪性中皮腫(がん)に対するα線放出核種を用いた治療薬候補の開発に成功し、動物実験によりその抗がん効果を明らかにしました。
中皮腫は、胸膜、腹膜などにある中皮から発生する悪性腫瘍で、80-85%が胸膜から発生します。中皮腫の原因のほとんどは、アスベストばく露です。2005年のクボタショック5)を契機に大きな社会問題となりました。日本国内における悪性中皮腫による死亡者数は増加の一途をたどっています。アスベストの輸入及び使用量は1970〜1980年代がピークで、2004年に全アスベストに対して原則使用禁止となりましたが、アスベストばく露から発症までの潜伏期間が25〜50年とされていることから、悪性中皮腫の発生ピークは2030年頃、罹患者数は年間3,000人に及ぶと予測されています。診断される患者の7割以上が進行がんであり、有効な治療法がなく予後が悪いため、新たな治療法が望まれています。
量研では、放射線の飛ぶ距離が細胞数個分と短く、当たった細胞を殺傷する能力が高いα線を放出する核種225Acを加速器で効率よく製造することに成功しています。225Acは、近年、前立腺がん特異的膜抗原(PSMA)を標的とした前立腺がんで注目されている標的アイソトープ治療用の放射性同位体です。
この225Acを中皮腫細胞だけに届けることが出来れば、飛距離の短いα線により、周囲の正常細胞を傷つけることなく、効率よくがん細胞を殺傷することが可能です。そこで、本研究チームは、中皮腫細胞の細胞表面に多く存在しているポドプラニン6)というタンパク質に結合する抗体NZ-16(以下、「NZ-16」という。」)を225Acで標識し、α線標的アイソトープ治療薬候補として225Ac標識NZ-16を開発しました。ポドプラニンは中皮腫の中でも特に悪性度の高い肉腫型でも高発現しているタンパク質で治療標的として有望です。
225Ac標識NZ-16を中皮腫のモデルマウスに1回投与したところ、腫瘍サイズを縮小させ、腫瘍をほぼ消失させる効果があることを確認しました。また、生存期間を延長させることも確認しました。一方で、副作用の指標となる体重減少や病理所見は認められませんでした。更に、α線と同様にがん細胞殺傷能力を有するβ線7)を放出する放射性同位体イットリウム90(90Y)を付加した90Y標識NZ-16と225Ac標識NZ-16の抗腫瘍効果を比べたところ、225Ac標識NZ-16は90Y標識NZ-16よりも高い腫瘍縮小効果があることを確認しました。これらの研究成果から、悪性中皮腫に対して、225Ac標識NZ-16によるα線標的アイソトープが副作用の少ない効果的な治療法となることが期待されます。現在、臨床応用に向けて関係機関と協力して準備を進めており、3年後のFirst-in-human試験の実施を目指しています。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「橋渡し研究プログラム」シーズB、および橋渡し研究支援拠点(東北大学)の支援により実施した成果を一部活用したもので、「Cells」(インパクトファクター6.6)2021年9月22日にオンライン掲載されました。
研究の背景と目的
中皮腫は、胸膜、腹膜などにある中皮から発生する悪性腫瘍で、80-85%が胸膜から発生します。中皮腫の原因のほとんどは、アスベストばく露です。2005年のクボタショックを契機に、大きな社会問題となりました。日本国内における悪性中皮腫による死亡者数は1995年の500人から、2000年710人、2005年911人、2015年1,504人、2017年1,555人 と確実に増加の一途をたどり、世界全体では年間4万人が死亡しています。アスベストの輸入及び使用量は1970〜1980年代がピークで、2004年に全アスベストに対して原則使用禁止となりましたが、アスベストばく露から発症までの潜伏期間が25〜50年とされていることから、日本では悪性中皮腫の発生ピークは2030年頃、罹患者数は年間3,000人、アスベスト使用禁止が遅れている先進国の一部と開発途上国でも患者の増大が予測されています。
診断される患者の7割以上が進行がんであり、外科療法、内科療法、放射線療法を組み合わせた最新の治療が行われていますが、有効な治療法がなく予後が悪いため、新たな治療法が望まれています。しかし、罹患率は日本国内で900人/年と患者が少ない、いわゆる希少がんであるため、民間企業による開発は活発ではなく、アカデミア主体での開発が必要な状況です。
量研は、放射線の飛ぶ距離が細胞数個分と短く、当たった細胞を殺傷する能力が高いα線を出す核種225Acを加速器で製造することに成功しています。この225Acを中皮腫細胞に効率よく届けることが出来れば、飛距離の短いα線により、周囲の正常組織に障害を与えることなく中皮腫を治療することが可能ではないかと研究チームは考えました。
225Acを中皮腫細胞に届ける手法として、中皮腫細胞の表面に高率に存在しているポドプラニンタンパク質に着目しました(図1)。ポドプラニンは、がんの悪性度にも関係しており、治療抵抗性の中皮腫細胞の治療標的分子として有望です。ポドプラニンを認識する抗体に225Acを結合すれば中皮腫細胞に届けられると考えられます。ところが、ポドプラニンはリンパ管内皮細胞にも存在しており、この細胞に225Acが届いてしまうと重篤な副作用が生じると懸念されていました。そこで本研究では、東北大学が開発した正常組織のポドプラニンを認識せず、腫瘍に発現しているポドプラニンだけを認識する抗体NZ-16を用いて、その抗体に225Acを付加した225Ac標識NZ-16を開発し、中皮腫に対する抗腫瘍抑制効果をモデル動物において評価しました。
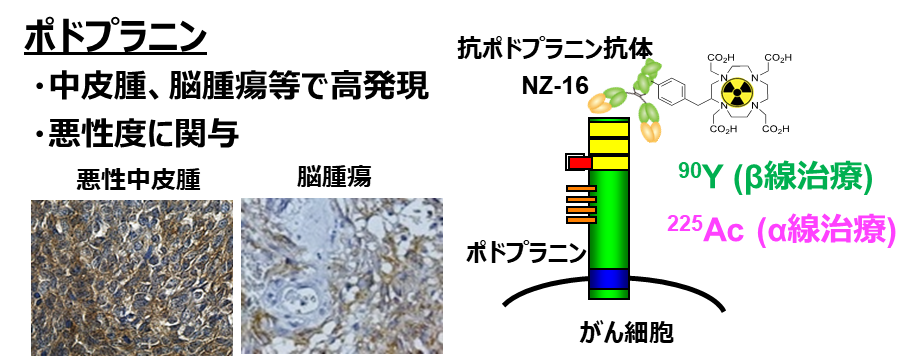
図1. ポドプラニン及び放射性標識抗体
ポドプラニンは、細胞膜表面に存在するタンパク質です。中皮腫、脳腫瘍
などで高発現しており、その悪性度に関与しています。本研究では抗ポドプ
ラニン抗体NZ-16を、α線放出核種アクチニウム225(225Ac)やβ線放出核種イ
ットリウム90(90Y)で放射性標識し、中皮腫モデルマウスで治療効果を評価しました。
