厚生労働省の薬事・食品衛生審議会 医薬品第二部会は5月30日、医薬品医療機器総合機構(PMDA)の審査段階で承認が了承され、本部会での審議が必要ないと判断された、【報告予定品目】について、全て了承した。
今回、適応拡大が了承されたのは、バイエル薬品株式会社(本社:大阪府大阪市北区梅田)が承認申請していた、ネクサバール®錠(一般名:ソラフェニブ)投与歴のある肝細胞癌(HCC=Hepatocellular carcinoma)患者に対する「がん化学療法後に増悪した切除不能な肝細胞がん」の効能・効果で、「スチバーガ®錠40mg(一般名:レゴラフェニブ水和物=regorafenib)」の追加が了承された。
肝細胞がん(HCC)は、肝がんに於いて、最も発生頻度が高く、(転移性を除く)原発性肝がん全体の約85~90%を占めています。
肝細胞がんは慢性肝疾患……特に肝硬変と関連しており、発生原因として、B型肝炎ウイルス及びC型肝炎ウイルスが挙げられますが、最近の調査では、非B型・非C型肝細胞がんの増加が報告されています。
肝細胞がんの第一治療選択肢は外科手術ですが、根治切除後の再発や、診断時には既に進行性で転移が見られる為、手術に適さない場合も多くあります。
全身化学療法歴の無い患者適応で承認されている薬剤は、これまで「ネクサバール®錠(一般名:ソラフェニブ:バイエル薬品:2009年5月承認)」のみで、有効な治療法の無いアンメット・メディカル・ニーズ(満たされていない医療上の必要性が高い疾患)の一つとなっています。
肝癌は直径2~3cmの大きさになると、門脈を経由して肝臓内各所に転移を始めます(肝内転移多発)。
一方、肝細胞がんは基礎疾患として慢性肝疾患、特に肝硬変がある事が多く、一旦、根治的に切除しても、新規の発がんを起こして再発する事も少なくありません(多中心性多発)。
毎年、世界で78万人以上(EU=5万2000人、西太平洋地域(日本を含む)=50万1000人、米国=3万人)が肝癌と診断されており、約74万6000人が肝癌の為に亡くなり、そのうち約4万8000人がEU、47万7000人が西太平洋地域、2万4000人が米国での死亡例でした。(GLOBOCAN2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012)
日本では年間、約3万1000人の肝癌による死亡者がおり、その約90%を原発性肝癌である肝細胞癌が占めています。(日本肝臓学会-平成27年度肝がん白書)
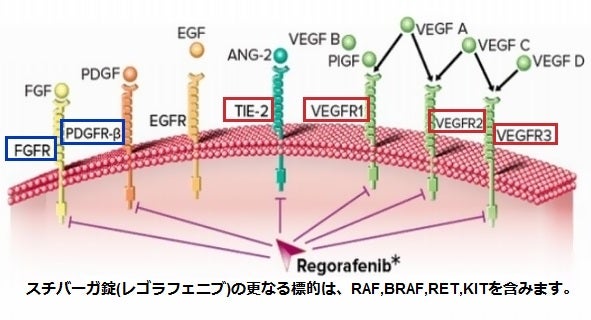
「スチバーガ®錠」は、腫瘍血管新生(VEGFR-1、VEGFR-2、VEGFR-3、TIE2)、発癌(KIT、RET、RAF-1、BRAF)、転移(VEGFR-3、PDGFR、FGFR)と腫瘍免疫(CSF1R)に関与する様々なプロテインキナーゼ(ATPのリン酸基をタンパク質の水酸基に転位させる酵素の総称)を強力に阻害する経口マルチキナーゼ阻害剤です。
「スチバーガ®錠40mg(一般名:レゴラフェニブ水和物)」は、過去10年間で、初めての新たな肝細胞癌(HCC)治療薬となる新効能医薬品であり、尚且つ、唯一の全身療法剤です。
また、第Ⅲ相臨床試験RESORCEではネクサバール®錠投与後に病勢進行を認めた肝細胞癌(HCC)患者に対して、二次治療として全生存期間(OS)の有意な延長が示された、初めての治療薬となりました。
本剤は、優先審査品目に指定され、再審査期間は残余(平成33年3月24日)となっている。
【薬価】:5579.3円
【用法・用量】は、本剤で既に適応を持つ「治癒切除不能な進行・再発の結腸・直腸がん」などと同じ。
海外では、肝細胞癌の適応について、米国食品医薬品局(FDA)で2017年4月に承認済、欧州医薬品庁(EMA)では審査中(2016年11月申請)である。