遺伝子ノックアウト(英: gene knockout)は、ある生物に機能欠損型の遺伝子 を導入するという、遺伝子工学 の技法。
この場合のノックアウトは「だめにする」「だめにされた」の意味。
この技法は、配列 (シークエンス)は既知であるが、機能がよくわかっていない遺伝子を研究するときに用いられる。研究者は、ノックアウト生物と正常個体の間の相違から、遺伝子の機能について推論する。
ノックアウトはしばしばKOと略される。
同時に2つの遺伝子をノックアウトすることを「ダブルノックアウト」(DKO)と言う。同様に、「トリプルノックアウト」(TKO)、「クアドラブルノックアウト」(QKO)はそれぞれ、同時に3個、4個の遺伝子をノックアウトすることである。
手法
遺伝子ノックアウトはいくつかの技法の組み合わせによって成り立つ。まず試験管内でプラスミド や、バクテリア人工染色体 (BAC )などのDNAコンストラクト (DNA構築物、人工的に組み立てられたDNAのこと)を作り出し、次に細胞培養 を行う。
細胞 は、DNAコンストラクトによって遺伝的に改変される。多くの場合、目的は、改変された遺伝子を持つ遺伝子組換え動物 をつくることである。
その場合、胚性幹細胞 に対して遺伝子組み替えを行い、初期胚 (胚盤胞 )の中に挿入する。そして生まれてくる生物のうちで、遺伝子組換え細胞が生殖系列 に分化したものが、ノックアウトされた遺伝子を次世代に残すことができる。
DNAコンストラクトは、標的遺伝子との間で遺伝的組換え が起こるように作られる。これは標的遺伝子自身のシークエンスをコンストラクトに組み入れることによって可能になる。
標的遺伝子の中間を、非機能のシークエンスで置き換えたDNAコンストラクトを作成する。そうすることで、その標的遺伝子の箇所でDNA組換え(相同組換え)が起こり、遺伝子の機能を損傷する外来のシークエンスが組み入れられることになる。
条件付きノックアウトの手法によって、組織特異的、もしくは時間特異的に、遺伝子を削除することができる。 詳しくは、Cre-loxP部位特異的組換え を参照。
それぞれの細胞とDNAコンストラクトにおいて、望ましいタイプのDNA組み替えが起こるのはまれである。このため、挿入するシークエンスには通常、レポーター遺伝子を含める。
これにより、遺伝子ノックアウトが成功している細胞・個体の選別が容易になる。また、DNAコンストラクトが、意図した目的遺伝子と相同組み替えを起こさず、遺伝子の別の箇所に挿入されてしまうことがしばしばある。このような細胞を除外するために、DNAコンストラクトにはそうなった細胞の識別と廃棄を可能にするための2番目のDNA領域を含んでいる。
二倍体 生物では、ほとんどの遺伝子において2つ組の対立遺伝子 が存在している。また、関係する複数の遺伝子が、同一の作用に対して働いている場合もある。
このような場合、すべての標的遺伝子をノックアウトするまで、遺伝子組み込みと選別の作業が繰り返される。ホモ接合型 の生物を作り出すためには、選択的な掛け合わせが必要になる場合もある。
遺伝子ノックイン は、遺伝子ノックアウトと類似の手法である。これは遺伝子を削除(無効化)するのではなくて、別の遺伝子を導入する。
筋肥大を抑制するミオスタチン
【筋量をコントロールするメカニズム:IGF-Iとミオスタチン】
トレーニングによって筋が肥大・成長するメカニズムはまだ完全には解明されていませんが、力学的ストレス、ホルモン、成長因子などのさまざまな要因がこれに関わっていると考えられます。
成長因子とは、内分泌腺以外のさまざまな細胞が分泌し、局所的にはたらいて細胞や組織の成長や分化を調節するホルモン様物質です。このうち、インスリン様成長因子-1(IGF-I)が、トレーニングによる筋肥大という観点では最もよく研究されています。
IGF-I にもいくつかのタイプがありますが、そのうちのひとつは筋線維そのものから分泌され、筋線維自身や周囲の細胞に作用して、筋肥大を促します。
「ウイルスベクター」という遺伝子の運び屋を利用してこのIGF-I遺伝子をマウスの筋に導入すると、特に運動しなくても筋が肥大することがわかっています。
一方、ミオスタチンは、筋で常につくられていて、その成長を強く抑制している成長因子です。
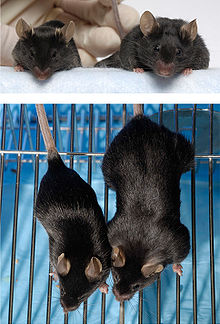
例えばミオスタチンの遺伝子を破壊したマウス(ノックアウトマウス)では、筋量が通常のマウスに比べて3倍にもなります。Guernecら(2003)は最近、(IGF-I/ミオスタチン)の発現比の上昇が筋の肥大や成長にとって重要であると報告しています。
【トレーニングによってミオスタチン発現が低下する】
ミオスタチンは発生段階での筋の成長にのみ関与し、胎児期に筋線維が過剰に増殖するのを抑えていると考えられていました。しかし、(Kawada, Tachi, Ishii, 2002)をはじめいくつかの研究が、過負荷によって成体の筋が肥大するときに、ミオスタチンの発現が低下することが分かりました。
トレーニングなどによって筋が肥大するときには、筋でのミオスタチンの発現が低下し、同時にIGF-Iの発現が上昇するものと考えられます。
これらの研究はマウスやラットを用いたものですが、最近Rothら(2003)は、ヒトの筋から採取したサンプルについて調べ、高強度のレジスタンストレーニングによって肥大した筋で確かにミオスタチンの発現が低下していることを示しました。
【抗ミオスタチン抗体の驚異的効果】
一方、ミオスタチンの作用を人為的にブロックする研究も行われてきました。
その中で最近、特筆すべき研究が2件報告されています。ひとつはBogdanovich ら(2002)が科学誌「ネイチャー」に報告したもの、他方は Whittemoreら(2003)の報告です。いすれも、ミオスタチンに対するモノクローナル抗体(特定のアミノ酸配列のみを認識して結合する、特異性の高い抗体)をマウスに注射(体重1kg当たり60mgを1回/週、腹腔内に)し、筋の変化を調べたものです。
成体内でつくられるミオスタチンに抗体が結合すれば、その作用が抑えられ、筋が肥大することが期待されます。
Bogdanovichらは筋ジストロフィーマウス(mdx)に3ヶ月間この抗体を注射し、
1)体重の増加(約30%)
2)エネルギー消費の増加(約30%)
3)筋重量の増加(約30%)
4)筋線維断面積の増加(約33%)
5)筋力の増加(約33%)
6)筋損傷の低減
などを認めました。Wittemoreらは同様の操作を通常のマウスに施し、やはり同様の効果を認めています。
彼らは注射をする時期と期間についても調べていて、完全に成長が止まった週齢のマウスでも筋肥大が起こること、2週間(たった2回の注射)でも約10%の筋量増加が起こることを報告しています。
【期待される臨床応用と増大するドーピングの危機】
これらの研究で示された抗ミオスタチン抗体の効果は驚異的とも言えますが、加えてその効果は筋に限定されていて、他の臓器への副作用は全く見られないとのことです。こうしたことから、筋ジストロフィーをはじめとした筋萎縮性疾患や老化による筋機能低下の治療への応用が期待されています。
遺伝子組み替えによってヒトの抗ミオスタチン抗体を量産する方法や、体内の免疫細胞に抗ミオスタチン抗体を生産する伝子を直接導入する方法の開発がすでに始まっているかもしれません。
しかし、臨床面での有用性が期待されるほど、ドーピングに悪用される危険性も高まるといえるでしょう。一方、研究での最前線から見れば、本物の「ミオスタチンブロッカー」が現時点で存在し、まして一般に出回る可能性は皆無に近いといえるでしょう。