スラミンがCOVID-19治療薬として期待される
Suramin shows promise as COVID-19 treatment
Dr. Liji Thomas, MD
By Dr. Liji Thomas, MDOct 12 2020
Scientists are anxiously searching for an effective antiviral to combat severe or critical COVID-19, which has already caused over a million deaths worldwide. A new study published on the preprint server bioRxiv* reports the elucidation of the mechanism of inhibition of SARS-CoV-2 by a non-nucleotide inhibitor called suramin. This is the first such compound to be shown to have such activity and shows promise for use as a repurposed drug against COVID-19.

スラミンがCOVID-19治療薬として期待される
Dr. Liji Thomas, MD
ドクター・リージ・トーマス(MD)Oct 12 2020
科学者たちは、すでに世界中で100万人以上の死亡者を出している重症または重篤なCOVID-19に対抗する効果的な抗ウイルス剤を待ち望んでいます。今回、プレプリントサーバーbioRxiv*に掲載された新しい研究では、スラミンと呼ばれる非ヌクレオチド阻害剤によるSARS-CoV-2の阻害メカニズムが解明されたことが報告されています。このような活性を示す化合物は初めてであり、COVID-19に対する再利用可能な薬剤としての利用が期待されます。
Suramin
Compared to the earlier highly pathogenic SARS-CoV and MERS-CoV, severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) has much greater transmissibility and has therefore caused a pandemic rather than a local outbreak. Suramin is a drug that has been used to treat African sleeping sickness and river blindness for over a hundred years. Suramin has also been shown to be an inhibitor against a wide variety of viruses, including Zika and Chikungunya viruses, indicating its diverse mechanisms of action against multiple viruses.
スラミン(松の木に含まれる成分)
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、先に発生した高病原性のSARS-CoVやMERS-CoVに比べ、感染力が非常に強いため、局所的な流行ではなくパンデミックを引き起こしている。スラミンは、100年以上前からアフリカ睡眠病や河川盲目症の治療に使われてきた薬です。また、スラミンは、ジカウイルスやチクングニアウイルスなど、さまざまなウイルスに対する阻害作用が確認されており、複数のウイルスに対する多様な作用機序を持っていることがわかります。
For instance, it can prevent viral attachment, entry, and release from host cells by its interactions with viral capsid proteins. Recent research has shown it to be an in vitro inhibitor of SARS-CoV-2 infection in cell culture by preventing viral entry. The current study shows this to be due to its potent inhibition of SARS-CoV-2 RNA-dependent RNA polymerase (RdRp), an essential viral lifecycle enzyme. Suramin is 20 or more times as powerful as remdesivir, which is the only currently approved anti-COVID-19 drug.
例えば、ウイルスのキャプシドタンパク質との相互作用により、ウイルスの付着、侵入、宿主細胞からの放出を防ぐことができるという。最近の研究では、ウイルスの侵入を防ぐことで、細胞培養におけるSARS-CoV-2の感染をin vitroで阻害することが示されている。今回の研究では、これはウイルスのライフサイクルに不可欠な酵素であるSARS-CoV-2のRNA依存性RNAポリメラーゼ(RdRp)を強力に阻害することによるものであることが示された。スラミンは、現在承認されている唯一の抗COVID-19薬であるレムデシビルの20倍以上の力を持っています。
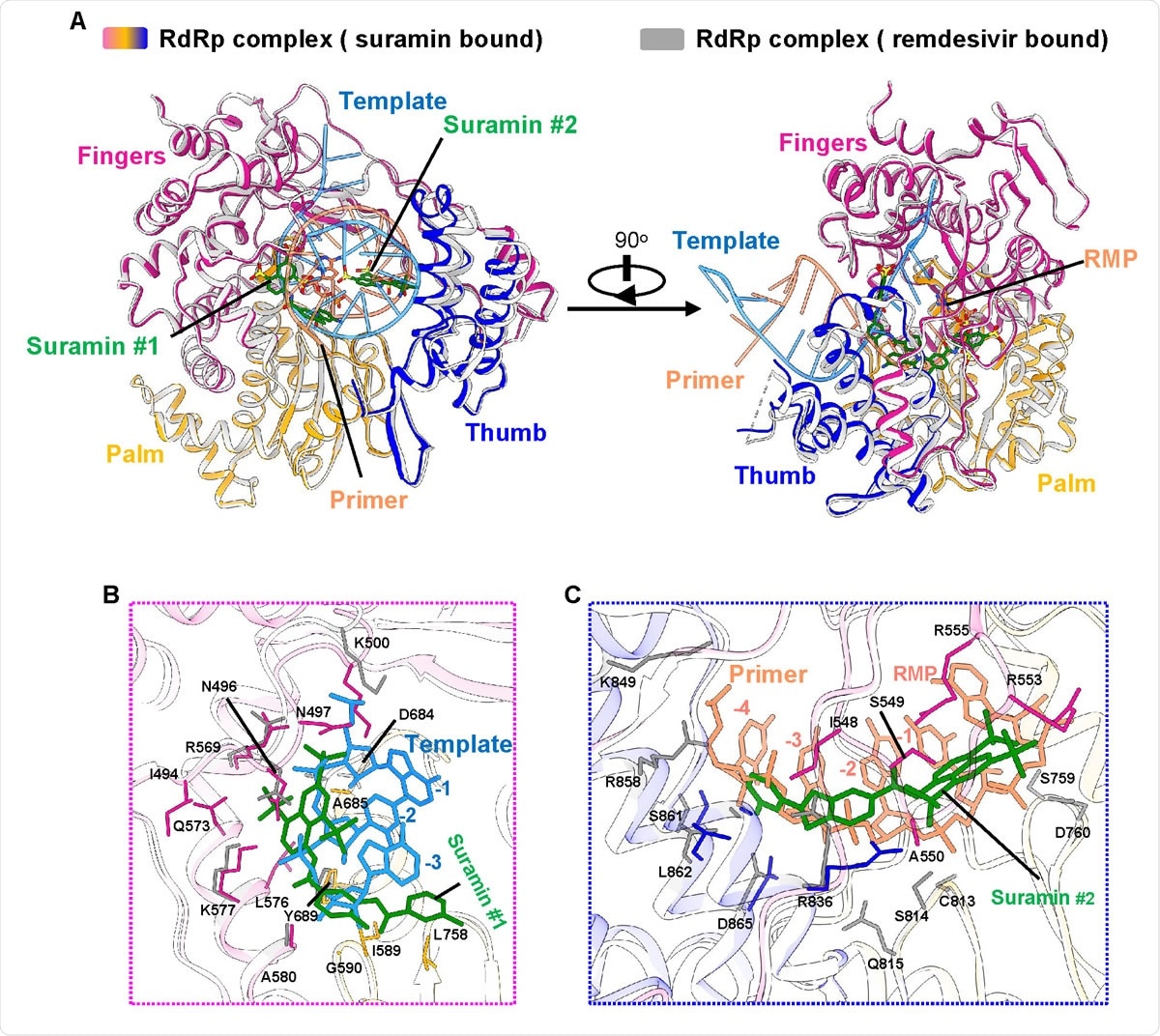
cryoEM studies reveal the binding of suramin to the RdRp catalytic site to prevent RNA and primer binding. This serves as a rationale to repurpose suramin for this virus as well as providing a design template of a structure that can be tweaked for newer derivatives of suramin.
Inhibition mechanism from comparison with the remdesivir-bound RdRp structure A. The two overall views of the RdRp-suramin complex overlapped with the remdesivir-bound RdRp structure (PDB ID: 7BV2). For clarity, only the polymerase domains are presented. The remdesivir bound RdRp structure is set as light gray, the template RNA is set as cyan, and the primer RNA is set as red. B. Close view of suramin #1 overlapped with RNA template strand. C. Close view of suramin #2 overlapped with RNA primer strand.
cryoEMを用いた研究により、スラミンがRdRpの触媒部位に結合し、RNAやプライマーの結合を阻害していることが明らかになった。これは、スラミンをこのウイルスに再利用するための根拠となるだけでなく、スラミンの新たな誘導体のために微調整できる構造のデザインテンプレートを提供するものである。
レムデシビルが結合したRdRpの構造との比較による阻害メカニズム A. RdRpとスラミンの複合体の2つの全体像は、レムデシビルが結合したRdRpの構造(PDB ID: 7BV2)と重なっている。わかりやすくするために、ポリメラーゼドメインのみを表示している。レムデシビルが結合したRdRp構造はライトグレー、鋳型RNAはシアン、プライマーRNAは赤で示している。B. スラミン#1がRNAのテンプレート鎖と重なっている様子を示す。C. スラミン#2がRNAプライマー鎖と重なった状態の拡大図。

Inhibition mechanism from comparison with the remdesivir-bound RdRp structure A. The two overall views of the RdRp-suramin complex overlapped with the remdesivir-bound RdRp structure (PDB ID: 7BV2). For clarity, only the polymerase domains are presented. The remdesivir bound RdRp structure is set as light gray, the template RNA is set as cyan, and the primer RNA is set as red. B. Close view of suramin #1 overlapped with RNA template strand. C. Close view of suramin #2 overlapped with RNA primer strand.
Inhibition of RdRp by suramin
SARS-CoV-2 has a core RNA polymerase made up of non-structural protein nsp12 and two accessory subunits nsp7 and nsp8. This complex is necessary for RNA-based RNA synthesis. This is almost entirely inhibited by 8-32 μM suramin compared to 100-1000 μM of remdesivir triphosphate form (RDV-TP). The same trend was seen when it comes to the complete abolition of RdRp-RNA complex formation, which required 100 μM of suramin but >5 mM of RDV-TP. The half-maximal inhibition concentration (IC50) of suramin is 0.26 μM but 6.21 μM for RDV-TP.
レムデシビル結合型RdRp構造との比較による阻害メカニズム A. レムデシビル結合型RdRp構造(PDB ID: 7BV2)と重なったRdRp-スラミン複合体の2つの全体像である。わかりやすくするために、ポリメラーゼドメインのみを表示している。レムデシビルが結合したRdRp構造はライトグレー、鋳型RNAはシアン、プライマーRNAは赤で示している。B. スラミン#1がRNAのテンプレート鎖と重なっている様子を示す。C. スラミン#2がRNAプライマー鎖と重なった状態の拡大図。
スラミンによるRdRpの阻害
SARS-CoV-2は、非構造タンパク質nsp12と2つのアクセサリーサブユニットnsp7およびnsp8からなるコアRNAポリメラーゼを有する。この複合体は、RNAベースのRNA合成に必要である。これは、100~1000μMのレムデシビル三リン酸体(RDV-TP)に比べ、8~32μMのスラミンでほぼ完全に阻害される。RdRp-RNA複合体形成の完全な消失に関しても同様の傾向が見られ、100μMのスラミンが必要であったが、5mM以上のRDV-TPが必要であった。スラミンの半減期阻害濃度(IC50)は0.26μMであるのに対し、RDV-TPは6.21μMであった。
Related Stories
Case study describes consequences of undetected SARS-CoV-2 infection during mRNA vaccination
Moderna and Pfizer-BioNTech vaccines induce robust T cell response against SARS-CoV-2 variants
Protein-based vaccines against SARS-CoV-2 may provide advantages over mRNA-based vaccines
This indicates that suramin is 20 times or more potent than RDV-TP. In cell culture, the former was shown to inhibit the duplication of the virus in Vero cells, the half-maximal effective concentration (EC50) being ~2.9 μM comparable to that of remdesivir.
関連記事
mRNAワクチン接種時にSARS-CoV-2の感染が検出されなかった場合のケーススタディ
SARS-CoV-2の亜種に対して、Moderna社とPfizer-BioNTech社のワクチンが強固なT細胞反応を引き起こす
SARS-CoV-2に対するタンパク質ベースのワクチンは、mRNAベースのワクチンよりも優れている可能性がある
これは、スラミンがRDV-TPの20倍以上の効力を持っていることを示している。細胞培養では、RDV-TPはVero細胞におけるウイルスの複製を阻害し、その半減期の有効濃度(EC50)はレムデシビルと同等の約2.9μMであった。
Why does suramin show weaker effects in cell culture? Researchers speculate that this is due to the high negativity of this molecule, which reduces its uptake by host cells. The CC50 (concentrations of drug required to reduce cell viability by 50%) of suramin is over 1000 μM, indicating its high margin of safety.
The structure of the RdRp-suramin complex
Using cryo-EM, the current researchers found that the RdRp-suramin complex has a very similar structure to the apo RdRp complex. Nsp 12 has the same right-hand palm-fingers configuration with a catalytic active site comprising seven motifs (A-G) that are highly conserved between coronaviruses. Two molecules of suramin fit into the catalytic chamber, one formed by motif G and motif B.
Chemically, suramin has a two-fold symmetry with a urea linker at the center. However, only half of it is defined clearly on the EM map, lacking the urea linker. The interactions between the RdRp and suramin involve hydrogen bonds, charge interactions, and hydrophobic packing interactions.
なぜスラミンは細胞培養で効果が弱いのか?研究者たちは、この分子の陰性度が高く、宿主細胞への取り込みが少ないためではないかと推測しています。スラミンのCC50(細胞の生存率を50%低下させるのに必要な薬剤の濃度)は1000μM以上であり、その安全性の高さが示されている。
RdRpとスラミンの複合体の構造
今回の研究では、クライオ電子顕微鏡を用いて、RdRp-スラミン複合体がアポRdRp複合体と非常によく似た構造をしていることを発見した。Nsp12は、コロナウイルス間で高度に保存されている7つのモチーフ(A~G)からなる触媒活性部位を持つ、同じ右手の手のひらのような形状をしている。触媒室には、モチーフGとモチーフBで形成される2分子のスラミンが収まっている。
化学的には、スラミンは中央に尿素リンカーを持つ2回対称の構造をしている。しかし、EMマップ上では、尿素リンカーを欠いた半分だけがはっきりと定義されている。RdRpとスラミンの間の相互作用には、水素結合、電荷相互作用、疎水性パッキング相互作用などがある。
A study of the alignment with RdRp from several viruses suggests that residues that come in contact with suramin are conserved, indicating the broad applicability of suramin to multiple viral infections.
Suramin Inhibits SARS-CoV-2 RdRp
Comparing the RdRp-suramin complex to the remdesivir-bound RdRp complex shows that the two suramin molecules occupy specific positions on the RNA strand and the primer strand, blocking the binding of the duplex RNA template-primer strand to the active site of the enzyme. Simultaneously it prevented the entry of nucleotide triphosphate into the catalytic site. This directly blocked RdRp catalytic activity.
This mechanism refers to SARS-CoV-2 RdRp inhibition, which is different from the suramin-mediated inhibition of the norovirus RdRp, though this also involves the binding of two molecules of suramin. Both suramin binding sites show half of the suramin molecule, but in comparison to the earlier enzyme, only one of the two sites shows a partial overlap. In the latter case, there is an indirect inhibition of RdRp polymerization since one binding site overlaps the proposed nucleotide entry channel.
複数のウイルスのRdRpとのアライメントを調べたところ、スラミンと接触する残基が保存されていることが示唆され、スラミンが複数のウイルス感染症に幅広く適用できることが示された。
スラミンはSARS-CoV-2のRdRpを阻害する
RdRp-スラミン複合体とレムデシビルが結合したRdRp複合体を比較すると、2つのスラミン分子がRNA鎖とプライマー鎖の特定の位置を占め、二重構造のRNAテンプレート-プライマー鎖が酵素の活性部位に結合するのを阻害することがわかった。同時に、触媒部位へのヌクレオチド三リン酸の進入も阻止した。これにより、RdRpの触媒活性が直接阻害された。
このメカニズムは、SARS-CoV-2のRdRpの阻害を意味しており、ノロウイルスのRdRpに対するスラミンによる阻害とは異なる。両方のスラミン結合部位は、スラミン分子の半分を示しているが、先の酵素と比較すると、2つの部位のうち1つだけが部分的に重なっていることがわかる。後者の場合、一方の結合部位が提案されているヌクレオチド進入チャネルと重なっているため、RdRpの重合が間接的に阻害されていると考えられる。
When other suramin derivatives are used, they bind at different orientations and conformations, and may thus also inhibit the SARS-CoV-2 RdRp.
Suramin derivatives Inhibit SARS-CoV-2 RdRp
Suramin-based drugs have been tested for chemotherapy of cancers and parasitic infestations. When screened in vitro, all the eight tested compounds were efficient RdRp inhibitors with five-fold potency relative to suramin. With micromolar effective concentrations, the cytotoxicity is low, indicating their potential utility for COVID-19 treatment. However, the previously observed discrepancy in the biochemical potency and cell-based assays is still present, indicating that these compounds are not well taken up by living cells in the host. Thus, the use of glycol chitosan-based nanoparticles to carry these drug particles into the cells may enhance their bioavailability in pulmonary tissues and their potency as viral inhibitors.
他のスラミン誘導体を使用した場合、それらは異なる方向性やコンフォメーションで結合するため、SARS-CoV-2 RdRpを阻害する可能性もある。
スラミン誘導体によるSARS-CoV-2 RdRpの阻害効果
スラミンをベースにした薬剤は、がんや寄生虫感染の化学療法に用いられてきた。in vitroでスクリーニングしたところ、8つのテスト化合物はすべて効率的なRdRp阻害剤であり、スラミンに対して5倍の効力を持っていた。マイクロモルの有効濃度では、細胞毒性は低く、COVID-19治療への有用性が期待される。しかし、以前に観察された生化学的な効力と細胞ベースのアッセイの不一致は依然として存在し、これらの化合物が宿主の生きた細胞にうまく取り込まれないことを示している。したがって、グリコールキトサンベースのナノ粒子を用いてこれらの薬剤粒子を細胞内に運ぶことで、肺組織でのバイオアベイラビリティーを高め、ウイルス阻害剤としての効力を高めることができるかもしれない。
Implications
The researchers show that suramin is a direct and potent viral RdRp inhibitor by direct inhibition, with structural analysis showing the mechanism of binding and inhibition. This is the first non-nucleotide inhibitor of the SARS-CoV-2 RdRp, and indicates the potential to develop suramin analogs and drug formulations as potent and effective inhibitors of viral replication.
意義
研究者らは、スラミンが直接的かつ強力なウイルスのRdRp阻害剤であることを、構造解析により結合と阻害のメカニズムを示している。これは、SARS-CoV-2 RdRpの初めての非ヌクレオチド系阻害剤であり、強力で効果的なウイルス複製の阻害剤として、スラミンのアナログおよび製剤を開発する可能性を示している。
Dr. Liji Thomas, MD
By Dr. Liji Thomas, MDOct 12 2020
Scientists are anxiously searching for an effective antiviral to combat severe or critical COVID-19, which has already caused over a million deaths worldwide. A new study published on the preprint server bioRxiv* reports the elucidation of the mechanism of inhibition of SARS-CoV-2 by a non-nucleotide inhibitor called suramin. This is the first such compound to be shown to have such activity and shows promise for use as a repurposed drug against COVID-19.

スラミンがCOVID-19治療薬として期待される
Dr. Liji Thomas, MD
ドクター・リージ・トーマス(MD)Oct 12 2020
科学者たちは、すでに世界中で100万人以上の死亡者を出している重症または重篤なCOVID-19に対抗する効果的な抗ウイルス剤を待ち望んでいます。今回、プレプリントサーバーbioRxiv*に掲載された新しい研究では、スラミンと呼ばれる非ヌクレオチド阻害剤によるSARS-CoV-2の阻害メカニズムが解明されたことが報告されています。このような活性を示す化合物は初めてであり、COVID-19に対する再利用可能な薬剤としての利用が期待されます。
Suramin
Compared to the earlier highly pathogenic SARS-CoV and MERS-CoV, severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) has much greater transmissibility and has therefore caused a pandemic rather than a local outbreak. Suramin is a drug that has been used to treat African sleeping sickness and river blindness for over a hundred years. Suramin has also been shown to be an inhibitor against a wide variety of viruses, including Zika and Chikungunya viruses, indicating its diverse mechanisms of action against multiple viruses.
スラミン(松の木に含まれる成分)
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、先に発生した高病原性のSARS-CoVやMERS-CoVに比べ、感染力が非常に強いため、局所的な流行ではなくパンデミックを引き起こしている。スラミンは、100年以上前からアフリカ睡眠病や河川盲目症の治療に使われてきた薬です。また、スラミンは、ジカウイルスやチクングニアウイルスなど、さまざまなウイルスに対する阻害作用が確認されており、複数のウイルスに対する多様な作用機序を持っていることがわかります。
For instance, it can prevent viral attachment, entry, and release from host cells by its interactions with viral capsid proteins. Recent research has shown it to be an in vitro inhibitor of SARS-CoV-2 infection in cell culture by preventing viral entry. The current study shows this to be due to its potent inhibition of SARS-CoV-2 RNA-dependent RNA polymerase (RdRp), an essential viral lifecycle enzyme. Suramin is 20 or more times as powerful as remdesivir, which is the only currently approved anti-COVID-19 drug.
例えば、ウイルスのキャプシドタンパク質との相互作用により、ウイルスの付着、侵入、宿主細胞からの放出を防ぐことができるという。最近の研究では、ウイルスの侵入を防ぐことで、細胞培養におけるSARS-CoV-2の感染をin vitroで阻害することが示されている。今回の研究では、これはウイルスのライフサイクルに不可欠な酵素であるSARS-CoV-2のRNA依存性RNAポリメラーゼ(RdRp)を強力に阻害することによるものであることが示された。スラミンは、現在承認されている唯一の抗COVID-19薬であるレムデシビルの20倍以上の力を持っています。
cryoEM studies reveal the binding of suramin to the RdRp catalytic site to prevent RNA and primer binding. This serves as a rationale to repurpose suramin for this virus as well as providing a design template of a structure that can be tweaked for newer derivatives of suramin.
Inhibition mechanism from comparison with the remdesivir-bound RdRp structure A. The two overall views of the RdRp-suramin complex overlapped with the remdesivir-bound RdRp structure (PDB ID: 7BV2). For clarity, only the polymerase domains are presented. The remdesivir bound RdRp structure is set as light gray, the template RNA is set as cyan, and the primer RNA is set as red. B. Close view of suramin #1 overlapped with RNA template strand. C. Close view of suramin #2 overlapped with RNA primer strand.
cryoEMを用いた研究により、スラミンがRdRpの触媒部位に結合し、RNAやプライマーの結合を阻害していることが明らかになった。これは、スラミンをこのウイルスに再利用するための根拠となるだけでなく、スラミンの新たな誘導体のために微調整できる構造のデザインテンプレートを提供するものである。
レムデシビルが結合したRdRpの構造との比較による阻害メカニズム A. RdRpとスラミンの複合体の2つの全体像は、レムデシビルが結合したRdRpの構造(PDB ID: 7BV2)と重なっている。わかりやすくするために、ポリメラーゼドメインのみを表示している。レムデシビルが結合したRdRp構造はライトグレー、鋳型RNAはシアン、プライマーRNAは赤で示している。B. スラミン#1がRNAのテンプレート鎖と重なっている様子を示す。C. スラミン#2がRNAプライマー鎖と重なった状態の拡大図。

Inhibition mechanism from comparison with the remdesivir-bound RdRp structure A. The two overall views of the RdRp-suramin complex overlapped with the remdesivir-bound RdRp structure (PDB ID: 7BV2). For clarity, only the polymerase domains are presented. The remdesivir bound RdRp structure is set as light gray, the template RNA is set as cyan, and the primer RNA is set as red. B. Close view of suramin #1 overlapped with RNA template strand. C. Close view of suramin #2 overlapped with RNA primer strand.
Inhibition of RdRp by suramin
SARS-CoV-2 has a core RNA polymerase made up of non-structural protein nsp12 and two accessory subunits nsp7 and nsp8. This complex is necessary for RNA-based RNA synthesis. This is almost entirely inhibited by 8-32 μM suramin compared to 100-1000 μM of remdesivir triphosphate form (RDV-TP). The same trend was seen when it comes to the complete abolition of RdRp-RNA complex formation, which required 100 μM of suramin but >5 mM of RDV-TP. The half-maximal inhibition concentration (IC50) of suramin is 0.26 μM but 6.21 μM for RDV-TP.
レムデシビル結合型RdRp構造との比較による阻害メカニズム A. レムデシビル結合型RdRp構造(PDB ID: 7BV2)と重なったRdRp-スラミン複合体の2つの全体像である。わかりやすくするために、ポリメラーゼドメインのみを表示している。レムデシビルが結合したRdRp構造はライトグレー、鋳型RNAはシアン、プライマーRNAは赤で示している。B. スラミン#1がRNAのテンプレート鎖と重なっている様子を示す。C. スラミン#2がRNAプライマー鎖と重なった状態の拡大図。
スラミンによるRdRpの阻害
SARS-CoV-2は、非構造タンパク質nsp12と2つのアクセサリーサブユニットnsp7およびnsp8からなるコアRNAポリメラーゼを有する。この複合体は、RNAベースのRNA合成に必要である。これは、100~1000μMのレムデシビル三リン酸体(RDV-TP)に比べ、8~32μMのスラミンでほぼ完全に阻害される。RdRp-RNA複合体形成の完全な消失に関しても同様の傾向が見られ、100μMのスラミンが必要であったが、5mM以上のRDV-TPが必要であった。スラミンの半減期阻害濃度(IC50)は0.26μMであるのに対し、RDV-TPは6.21μMであった。
Related Stories
Case study describes consequences of undetected SARS-CoV-2 infection during mRNA vaccination
Moderna and Pfizer-BioNTech vaccines induce robust T cell response against SARS-CoV-2 variants
Protein-based vaccines against SARS-CoV-2 may provide advantages over mRNA-based vaccines
This indicates that suramin is 20 times or more potent than RDV-TP. In cell culture, the former was shown to inhibit the duplication of the virus in Vero cells, the half-maximal effective concentration (EC50) being ~2.9 μM comparable to that of remdesivir.
関連記事
mRNAワクチン接種時にSARS-CoV-2の感染が検出されなかった場合のケーススタディ
SARS-CoV-2の亜種に対して、Moderna社とPfizer-BioNTech社のワクチンが強固なT細胞反応を引き起こす
SARS-CoV-2に対するタンパク質ベースのワクチンは、mRNAベースのワクチンよりも優れている可能性がある
これは、スラミンがRDV-TPの20倍以上の効力を持っていることを示している。細胞培養では、RDV-TPはVero細胞におけるウイルスの複製を阻害し、その半減期の有効濃度(EC50)はレムデシビルと同等の約2.9μMであった。
Why does suramin show weaker effects in cell culture? Researchers speculate that this is due to the high negativity of this molecule, which reduces its uptake by host cells. The CC50 (concentrations of drug required to reduce cell viability by 50%) of suramin is over 1000 μM, indicating its high margin of safety.
The structure of the RdRp-suramin complex
Using cryo-EM, the current researchers found that the RdRp-suramin complex has a very similar structure to the apo RdRp complex. Nsp 12 has the same right-hand palm-fingers configuration with a catalytic active site comprising seven motifs (A-G) that are highly conserved between coronaviruses. Two molecules of suramin fit into the catalytic chamber, one formed by motif G and motif B.
Chemically, suramin has a two-fold symmetry with a urea linker at the center. However, only half of it is defined clearly on the EM map, lacking the urea linker. The interactions between the RdRp and suramin involve hydrogen bonds, charge interactions, and hydrophobic packing interactions.
なぜスラミンは細胞培養で効果が弱いのか?研究者たちは、この分子の陰性度が高く、宿主細胞への取り込みが少ないためではないかと推測しています。スラミンのCC50(細胞の生存率を50%低下させるのに必要な薬剤の濃度)は1000μM以上であり、その安全性の高さが示されている。
RdRpとスラミンの複合体の構造
今回の研究では、クライオ電子顕微鏡を用いて、RdRp-スラミン複合体がアポRdRp複合体と非常によく似た構造をしていることを発見した。Nsp12は、コロナウイルス間で高度に保存されている7つのモチーフ(A~G)からなる触媒活性部位を持つ、同じ右手の手のひらのような形状をしている。触媒室には、モチーフGとモチーフBで形成される2分子のスラミンが収まっている。
化学的には、スラミンは中央に尿素リンカーを持つ2回対称の構造をしている。しかし、EMマップ上では、尿素リンカーを欠いた半分だけがはっきりと定義されている。RdRpとスラミンの間の相互作用には、水素結合、電荷相互作用、疎水性パッキング相互作用などがある。
A study of the alignment with RdRp from several viruses suggests that residues that come in contact with suramin are conserved, indicating the broad applicability of suramin to multiple viral infections.
Suramin Inhibits SARS-CoV-2 RdRp
Comparing the RdRp-suramin complex to the remdesivir-bound RdRp complex shows that the two suramin molecules occupy specific positions on the RNA strand and the primer strand, blocking the binding of the duplex RNA template-primer strand to the active site of the enzyme. Simultaneously it prevented the entry of nucleotide triphosphate into the catalytic site. This directly blocked RdRp catalytic activity.
This mechanism refers to SARS-CoV-2 RdRp inhibition, which is different from the suramin-mediated inhibition of the norovirus RdRp, though this also involves the binding of two molecules of suramin. Both suramin binding sites show half of the suramin molecule, but in comparison to the earlier enzyme, only one of the two sites shows a partial overlap. In the latter case, there is an indirect inhibition of RdRp polymerization since one binding site overlaps the proposed nucleotide entry channel.
複数のウイルスのRdRpとのアライメントを調べたところ、スラミンと接触する残基が保存されていることが示唆され、スラミンが複数のウイルス感染症に幅広く適用できることが示された。
スラミンはSARS-CoV-2のRdRpを阻害する
RdRp-スラミン複合体とレムデシビルが結合したRdRp複合体を比較すると、2つのスラミン分子がRNA鎖とプライマー鎖の特定の位置を占め、二重構造のRNAテンプレート-プライマー鎖が酵素の活性部位に結合するのを阻害することがわかった。同時に、触媒部位へのヌクレオチド三リン酸の進入も阻止した。これにより、RdRpの触媒活性が直接阻害された。
このメカニズムは、SARS-CoV-2のRdRpの阻害を意味しており、ノロウイルスのRdRpに対するスラミンによる阻害とは異なる。両方のスラミン結合部位は、スラミン分子の半分を示しているが、先の酵素と比較すると、2つの部位のうち1つだけが部分的に重なっていることがわかる。後者の場合、一方の結合部位が提案されているヌクレオチド進入チャネルと重なっているため、RdRpの重合が間接的に阻害されていると考えられる。
When other suramin derivatives are used, they bind at different orientations and conformations, and may thus also inhibit the SARS-CoV-2 RdRp.
Suramin derivatives Inhibit SARS-CoV-2 RdRp
Suramin-based drugs have been tested for chemotherapy of cancers and parasitic infestations. When screened in vitro, all the eight tested compounds were efficient RdRp inhibitors with five-fold potency relative to suramin. With micromolar effective concentrations, the cytotoxicity is low, indicating their potential utility for COVID-19 treatment. However, the previously observed discrepancy in the biochemical potency and cell-based assays is still present, indicating that these compounds are not well taken up by living cells in the host. Thus, the use of glycol chitosan-based nanoparticles to carry these drug particles into the cells may enhance their bioavailability in pulmonary tissues and their potency as viral inhibitors.
他のスラミン誘導体を使用した場合、それらは異なる方向性やコンフォメーションで結合するため、SARS-CoV-2 RdRpを阻害する可能性もある。
スラミン誘導体によるSARS-CoV-2 RdRpの阻害効果
スラミンをベースにした薬剤は、がんや寄生虫感染の化学療法に用いられてきた。in vitroでスクリーニングしたところ、8つのテスト化合物はすべて効率的なRdRp阻害剤であり、スラミンに対して5倍の効力を持っていた。マイクロモルの有効濃度では、細胞毒性は低く、COVID-19治療への有用性が期待される。しかし、以前に観察された生化学的な効力と細胞ベースのアッセイの不一致は依然として存在し、これらの化合物が宿主の生きた細胞にうまく取り込まれないことを示している。したがって、グリコールキトサンベースのナノ粒子を用いてこれらの薬剤粒子を細胞内に運ぶことで、肺組織でのバイオアベイラビリティーを高め、ウイルス阻害剤としての効力を高めることができるかもしれない。
Implications
The researchers show that suramin is a direct and potent viral RdRp inhibitor by direct inhibition, with structural analysis showing the mechanism of binding and inhibition. This is the first non-nucleotide inhibitor of the SARS-CoV-2 RdRp, and indicates the potential to develop suramin analogs and drug formulations as potent and effective inhibitors of viral replication.
意義
研究者らは、スラミンが直接的かつ強力なウイルスのRdRp阻害剤であることを、構造解析により結合と阻害のメカニズムを示している。これは、SARS-CoV-2 RdRpの初めての非ヌクレオチド系阻害剤であり、強力で効果的なウイルス複製の阻害剤として、スラミンのアナログおよび製剤を開発する可能性を示している。
※スラミン(松の木に含まれる成分)摂取については自己責任です。